(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案 。
依据题目要求回答下列问题。
(1)常温下,浓度均为 0.l mol·L-1的下列六种溶液的pH如下表:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
①上述盐溶液中的阴离子,结合H+能力最强的是。
②浓度均为0.0l mol·L-1的下列五种物质的溶液中,酸性最强的是(填编号);将各溶液分别稀释100倍,pH变化最小的是(填编号)
A. HCN B. HClO C. C6H5OH D. CH3COOH E. H2CO3
③据上表数据,请你判断下列反应不能成立的是(填编号)
A. CH3COOH + Na2CO3 = NaHCO3 + CH3COONa
B. CH3COOH + NaCN = CH3COONa + HCN
C. CO2 + H2O + NaClO = NaHCO3 + HClO
D. CO2 + H2O + 2C6H5ONa = Na2CO3 + 2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为。
(2)已知常温下Cu(OH)2的Ksp=2×10—20。又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_。
A与B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol.L-1。反应进行2min后,A的浓度为0.8 mol.L-1 ,B的浓度为0.6 mol.L-1 C的浓度为0.6 mol.L-1
(1)2min内反应的平均反应速率为: ν(A)=
(2)ν(A)、ν(B)、ν(C) 三者之间的关系是:
(3)该反应的化学反应方程式:
根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变(△H)。
C(石墨)+ O2(g)=CO2(g)△H1="a" kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2="b" kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3="c" kJ·mol-1
△H=。
某研究性学习小组探究Na与CO2的反应,设计了如下装置进行探究。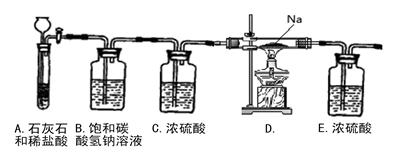
(1)从试剂瓶中取出的金属钠,须经过必要的操作,方可进行后续的实验,该必要的操作是。该装置B中饱和碳酸氢钠溶液的作用是,装置E中浓硫酸的作用是
(2)放进玻璃管中的金属钠在加热之前,必须先打开活塞,通入CO2, 这样操作的原因是
(3)用酒精灯给玻璃管加热,Na在充满CO2气体的玻璃管里剧烈地燃烧,产生大量的白烟。玻璃管中有黑色物质生成。玻璃管冷却后,玻璃管壁上附着一层白色物质。将玻璃管内物质转移至烧杯中, 加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往滤液中加CaCl2溶液,溶液变白色浑浊;再滴入稀盐酸,溶液中有气泡出现,则玻璃管壁上附着的白色物质是。另将滤纸上的黑色物质干燥,点燃,其燃烧产物无色无味且能使澄清石灰水变浑浊,则玻璃管中的黑色物质是。
(4)Na与CO2的反应的方程式为
将大豆油进行如下图所示的实验操作,请据此回答以下问题: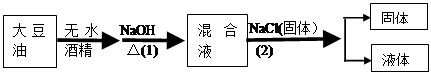
(1)该实验操作第(1)步中,化学反应类型为,检验该反应是否完全的方法是
(2)该实验操作第(2)步中,加固体NaCl的作用是,所得固体的主要用途是