某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究。
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙。但其中是否含有氯化氢需要通过实验来证明。
【查阅资料】氯化钙溶液呈中性。
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温。
| |
实验操作 |
实验现象 |
实验结论 |
| 甲同学 |
取烧杯中溶液少许于试管中,向其中滴加______ |
现象:溶液变为红色 |
溶液显酸性(含有H+);溶质中有氯化氢。 |
| 乙同学 |
取烧杯中溶液少许于试管中,向其中加入少量锌粒 |
现象:_________________________ 反应的化学方程式是: _______________________________ |
|
| 丙同学 |
取烧杯中溶液少许于试管中,向其中加入少量石灰石 |
现象:_________________________ 反应的化学方程式是:____________ |
【拓展提高】若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的____________(填化学式),经过滤、____________操作后即可完成。
.绿色植物的呼吸作用会产生二氧化碳,小明猜想:种子的萌发过程可能也会产生二氧化碳,他设计了如图实验装置。打开D装置中的阀门,水位下降,空气就会依次进入装置。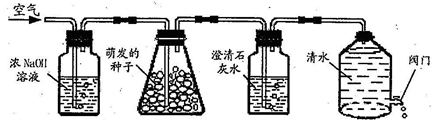
ABC D
(1)按照实验设计意图,如果观察到C装置中澄清石灰水变浑浊现象,则小明的猜想是正确的。但思维严密的小庭却认为实验还有漏洞,她建议在(选填:AB、BC或CD)之间再增加一个C装置,就可以弥补上图实验设计的不足,那么,改进后的实验装置中,当观察到现象时才能证明小明的猜想是正确的。
(2)请指出D装置的一个优点:。
请参与某学习小组进行研究性学习的过程,并协助完成相关任务:
[提出问题] 在平时探讨酸的性质时,我们通常是讨论酸的水溶液。究竟水在酸显示酸的特性时扮演什么角色呢?
[确定研究对象] 以我们最熟知的盐酸(氯化氢的水溶液)和氯化氢进行探究。[查阅资料] 氯化氢溶于水时解离出氢离子和氯离子,而溶于干燥的甲苯(一种有机溶剂)时仍以氯化氢分子的形式分散(如下图)。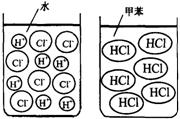
[设计与实验] (请完成下表)
| 实验内容 |
实验现象 |
解释与结论 |
| 测定导电性 |
氯化氢的水溶液:导电性良好 |
氯化氢的水溶液中有自由移动的离子 |
| 氯化氢的的甲苯溶液:A |
氯化氢的甲苯溶液中没有自由移动的离子 |
|
| 与镁作用 |
氯化氢的水溶液: B |
化学方程式: C |
| 氯化氢的甲苯溶液:没有明显的现象 |
氯化氢在甲苯溶液中没有解离出氢离子 |
|
| 与固体碳酸钠的作用 |
氯化氢的水溶液:产生气泡 |
化学方程式: D |
| 氯化氢的甲苯溶液: |
氯化氢在甲苯中没有解离出氢离子 |
[讨论与反思] 盐酸的酸性是因为氯化氢在水分子的作用下解离出了_______________E____。
小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
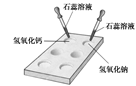
(1) 如右图所示,在白色点滴板上进行实验,请将实验现象填入下表:
| 氢氧化钠溶液 |
氢氧化钙溶液 |
|
| 加紫色石蕊溶液 |
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方程式。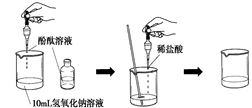
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式。
(4)如右图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成
为止。
这一实验说明:酸与碱作用生成了盐和水,这一反应叫做反应。中和反应的实质是;实验中滴加酚酞的作用是。
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。(任写两点)
①②
化学兴趣小组同学在帮助老师整理实验室时,发现了半瓶久置的氢氧化钙粉末,他们决定对这半瓶氢氧化钙粉末的组成进行实验探究。
(1)提出问题:这瓶氢氧化钙是否已经变质?
(2)猜想与假设:该氢氧化钙粉末的成分为①氢氧化钙;②氢氧化钙、碳酸钙;③。
(3)设计方案、进行实验:请你参与探究,并填写下表。
| 实验步骤 |
实验现象 |
实验结论 |
| ①取样品少量于小烧杯中,加入适量水,充分搅拌,过滤。 |
||
| ②。 |
大量气泡 产生 |
氢氧化钙已经变质。 |
| ③取少量滤液于试管中,。 |
氢氧化钙没有完全变质。 该反应的化学方程式为。 |
(4)联想与启示:氢氧化钙变质是由于它与空气中的发生化学反应的缘故,因此氢氧化钙应保存。
请根据图示回答下列问题:
(1)写出图一中标号的仪器名称:①,②;
(2)某同学欲用图一装置制取氧气,可选择的物质是(填化学式),用该物质制取氧气的化学方程式为;
(3)某化学小组同学设计了气体制取与性质验证的组合装置(如图二)。打开分液漏斗活塞放出一定量过氧化氢溶液后,关上活塞,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中。请看图回答下列问题:
①B中白磷能够在水下燃烧的原因是。②E中的实验现象是。
③用F装置收集气体的依据是。④ D中反应的化学方程式为。