(7分)某化学实验室产生的废液中含有Fe3+、Cu2+、Ca2+、Cl-四种离子,为了处理废液,回收金属并制备氯化铁晶体,现设计如下实验过程(部分):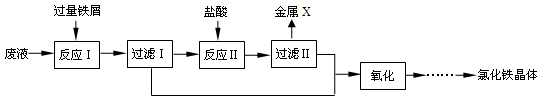
(1)金属X的化学式为 。实验室进行过滤操作除需要用到烧杯、玻璃棒和铁架台(带铁圈)外,还需要的实验用品是 。
(2)已知“反应Ⅰ”中,2FeCl3+ Fe=3FeCl2,发生的另一反应化学方程式为 ;
“反应Ⅱ”的化学方程式为 。
(3)“氧化”中,化合价发生变化的金属元素是 。
某化学兴趣小组回收利用废旧干电池。
实验 1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可于水。兴趣小组的同学们设计回收物质的流程如图1所示。
(1)操作1 和操作2 的名称都是,该操作中玻璃棒的作用是。
(2)灼烧滤渣 l 的目的是。
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度氯化锌的溶解度(填"<"、"="或">")。
实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
① 应选择:发生装置为(填编号),排空气法收集装置为(填编号)。
② 若用排水法收集并测定气体的体积,气体从装置
导管口(填"
"或"
") 进;选用仪器
测量排出水的体积,仪器
名称是。
(5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前
内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 |
试剂 |
前
内产生的氢气体积(
) |
|
| 不同纯度的锌 |
不同体积和浓度的稀硫酸 |
||
| a |
纯锌 |
30
30 % |
564.3 |
| b |
含杂质的锌 |
30
30 % |
634.7 |
| c |
纯锌 |
30
20 % |
449.3 |
| d |
纯锌 |
40
30 % |
602.8 |
① 比较实验
和实验
,可以得到的结论是。
② 为了研究硫酸浓度对反应快慢的影响,需比较实验和实验(填编号)。
③ 控制其他条件相同,需控制的条件是(例举一种条件即可)。
我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献。用"侯氏制碱法"制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案进行试验。
资料摘要:
Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳。
[方案一] 样品与氯化钙溶液反应,测定
的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 |
实验现象 |
实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的
溶液。 |
产生白色沉淀 |
反应的化学方程式: |
(2)分析滴加的
溶液要过量的原因:;
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算
的质量分数为91%。如果不洗涤沉淀物会造成测定结果大于91%,这是因为。
[方案二] 样品与稀盐酸反应,测定
的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的
气体的质量,计算
的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的)。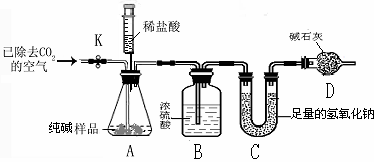
(4)打开止水夹
,先对装置
和
(已连接)通入已除去
的空气一会儿,以排尽装置
和
中含有的,再接上装置
和
。
(5)关闭止水夹
,加入足量的稀盐酸(杂质不与盐酸反应),装置
中样品产生气体的化学方程式为。
(6)待装置
中的反应结束后,再一次打开止水夹
,继续往装置通入已除去
的空气一会儿。根据定律,装置(填标号)在反应前后的质量差就是产生
的质量,由此计算出该样品中
的质量分数。若没有装置
,将会使测定结果(选填"偏大"或"偏小")。
仓库中有一包氮肥的包装标签模糊不清,有同学进行了以下探究:
(1)操作③用玻棒搅拌的目的是。
(2)请完成下表(已知AgCl和BaSO4是难溶于水和酸的白色固体):
| 假设和现象 |
判断和化学方程式 |
|
| 若现象
为无氨味。 |
则样品中不含(填名称)。 |
|
| 由操作②现象判断。 |
该样品一定含有离子。 |
|
| 若现象
为白色沉淀,现象
为无沉淀。 |
则样品中含有(写名称),该反应的化学方程式为。 |
|
| 若现象
为"无沉淀",现象
为白色沉淀。 |
则样品中含有(写化学式),该反应的化学方程式为。 |
(3)若现象
、
都无现象,则该氮肥可能是(写化学式);若操作②现象为无气味、现象
、
无现象,则该氮肥可能是(只写一种)。
实验与探究是化学学习的重要方法和内容。
(1)今年5月,我市各学校进行了实验操作考查。小张同学进行的实验考查是"用稀盐酸鉴别氢氧化钠(
)溶液和碳酸钠(
)溶液,并测定碳酸钠溶液的
"。
①小张同学的实验记录如下表,请补充完整:
| 操作步骤 |
现象记录 |
反应的化学方程式 |
| 取两支试管,分别往试管中加入2
样品1、2,再往其中滴入盐酸 |
样品1:无明显现象 |
|
| 样品2:溶液中出现气泡 |
②用
试纸测定碳酸钠溶液的酸碱度,简述操作的主要步骤:。
(2)在实验台上有三瓶未贴标签的溶液,已知分别是碳酸钠溶液、氢氧化钠溶液和稀盐酸。为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按
、
、
进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如下图所示的探究活动: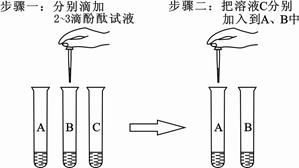
步骤一中,
无明显现象,
、
溶液的颜色变成红色;
步骤二中,
、
溶液的颜色由红色变成无色,且
溶液中有气泡冒出。
①根据上述实验现象可知,
、
溶液分别是、。
②某小组同学在进行步骤一实验时出现异常现象:往
溶液中加入酚酞试液时,溶液颜色先变成红色,振荡后迅速变成无色。老师指出这是因为溶液浓度过大造成的。接着,老师往该试管的溶液中加入适量盐酸,观察到
溶液的颜色又变成红色,此时溶液中含有的溶质主要是(酚酞除外)。
酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有生成。
(2)某化学小组进行"酸和碱的中和反应"实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知
溶液呈中性。请填写下表:
| 实验操作 | 测定结果 | 白色固体成分 |
| 用 试纸测定反应后溶液的酸碱度,操作方法是 |
|
|
|
|
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)"粗盐提纯"指除去
中的泥沙和
、
、
等杂质。
某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的
、
、
溶液,充分反应后过滤,蒸发结晶。请回答:
| 部分物质的溶解性表(室温) |
||||
| 溶、挥 |
溶 |
溶、挥 |
||
| 溶 |
溶 |
不溶 |
不溶 |
|
| 微溶 |
溶 |
微溶 |
不溶 |
|
| 不溶 |
溶 |
溶 |
微溶 |
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入
溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充。
(4)
和
的化学性质相似。"神舟"飞船内,可用盛有
的过滤网吸收航天员呼出的气体,以降低
含量。请计算:用
完全吸收176
生成
和
,理论上至少需要
的质量是多少?