[化学—有机化学基础]
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。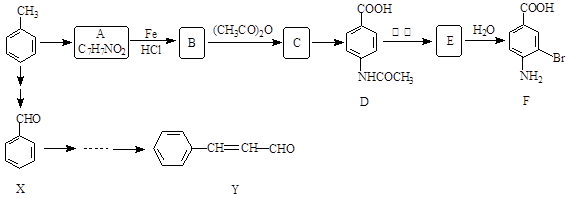
已知: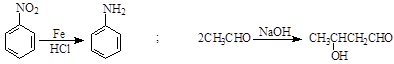 。
。
请回答下列问题:
(1)写出Y中含氧官能团的名称 。
(2)下列有关F的说法正确的是 。
| A.分子式是C7H7NO2Br | B.既能与盐酸反应又能与NaOH溶液反应 |
| C.能发生酯化反应 | D.1 mol F最多可以消耗2 mol NaOH |
(3)写出由甲苯→A反应的化学方程式 。
(4)在合成F的过程中,B→C步骤不能省略,理由是 ;
F在一定条件下形成的高分子化合物的结构简式是 。
(5)写出一种同时符合下列条件的Y的同分异构体的结构简式 。
①苯环上只有两种不同化学环境的氢原子 ②与足量浓溴水反应产生白色沉淀
③分子中只存在一个环状结构
(6)以X和乙烯为原料可合成Y,依次指出三步合成过程中三个主要反应的反应类型:
、 、 。
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素,试回答下列问题:
| A |
R |
||||||||||||||||
| B |
C |
D |
E |
F |
T |
||||||||||||
| G |
H |
I |
J |
K |
L |
||||||||||||
| M |
N |
||||||||||||||||
(1)请写出G的淡黄色化合物与二氧化碳反应的方程式。
(2)D的气态氢化物的VSEPR模型为_,其中心原子的杂化类型为_______。
(3)G、H和I的第一电离能数值由大到小的顺序为:(用元素符号作答)。
(4)由A、C、D形成的1mol ACD分子中,含有个σ键,个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的
元素还有_______________(填元素符号),其中一种金属的晶胞结构如右
图所示,该晶胞中含有金属原子的数目为。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2
是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有____________(填分子式)。
有A、B、C、D、E 五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)写出下列元素的符号B________ C_________ E__________。
(2)由这五种元素组成的一种化合物是_______________(写化学式)。
(3)元素电负性为B_______D。(填“﹥”、“﹤”或“﹦”)
(8分)根据要求完成下列问题:
(1)某元素原子共有6个价电子,其中一个价电子位于第四能层s轨道,试回答:
该元素的原子结构示意图______________,价电子排布的轨道表示式。该元素的原子序数为______,该元素是______元素(填“金属”或“非金属”),最高正化合价为______价。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:___ 、_____、_________。
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________
往Na2A溶液中加入可抑制其水解
A NaOH固体 B氯化铁固体 C 水 D碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。