汽车尾气是城市空气的主要污染物之一,其主要有害成分是CO、氮氧化物(NOx)等。
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,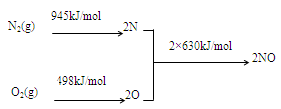
则:N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。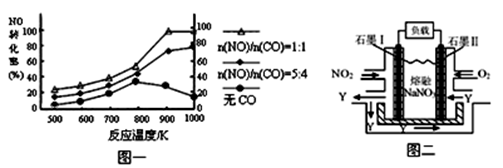
① NO与CO混存时,相互反应的化学方程式为 。
② 1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为 。
③ 由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在 K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以 NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
① 图中石墨Ⅱ为电池的 极。
② 在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为 。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g)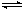 CH3OH(g)+H2O(g) ΔH<0合成甲醇。
CH3OH(g)+H2O(g) ΔH<0合成甲醇。
① 在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为 。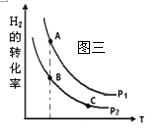
② 某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为 。
在25℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15 L,其中O2占L,则原CO和H2的混合气体中V(CO)= L,
L,
V(H2)=L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO):V(H2) =。
(3)若剩余气体的体积为a L,则a的取值范围是。
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式: □C+□+□H2SO4
□C+□+□H2SO4 □+□+□Cr2(SO4)3+□H2O
□+□+□Cr2(SO4)3+□H2O
(2)上述反应中氧化剂是(填化学式),被氧化的元素是(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为。
“绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为:KCN+H2O2+H2O A+NH3↑
A+NH3↑
回答下列问题:
(1)生成物A的化学式为。
(2)在标准状况下有0.448L氨气生成,则转移的电子数为 .。
(3)H2O2被称为“绿色试剂”的理由是。
(8分)A、B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO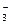 、SO
、SO 、Cl-、CO
、Cl-、CO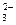 的中的一种。
的中的一种。
①若把四种盐分别溶解于盛有蒸气水的四支试管中,只有C盐的溶液呈蓝色。
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据①②实验事实可推断它们的化学式为:
(1)A,C
(2)写出盐酸与D反应的离子反应方程式:
(3)写出C与Ba(OH)2溶液反应的离子方程式
(8分)如图所示,在一条鱼、虾几乎绝迹的河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水检测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清。请回答:
(1)四座工厂排出的废水里含有的污染物分别为:
甲:乙:丙:丁:(填化学式)
(2)在丁的下游M处取出的河水中,肯定含有的离子是。
(3)写出有关反应的离子方程式:
。