I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下: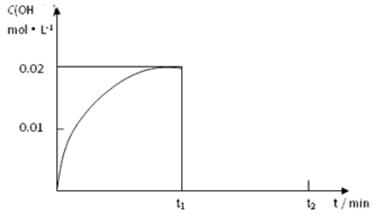
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
( 4 分)据都市晨报报道,2009年1月13日一天徐州市就发生火灾19起。干粉灭火器是常用的灭火器之一,它利用压缩的二氧化碳吹出白色干粉来灭火。这种灭火器可用来扑灭油、气等燃烧引起的火灾,其中干粉的主要成分是碳酸氢钠(NaHCO3),它受热后生成纯碱、水和二氧化碳。请回答下列问题:[来(1)请写出一条碳酸氢钠的化学性质。
(2)灭火时碳酸氢钠发生反应的化学方程式。
(3)点燃的镁条能在二氧化碳中继续燃烧,生成一种金属氧化物和一种非金属单质,因此金属镁着火时不能干粉灭火剂灭火,请写出镁在二氧化碳中燃烧的化学方程式,属于反应类型。(选填“分解反应”、“化合反应”、“置换反应”、“复分解反应”中的一项)
(5 分)膳食合理有利于人体健康,应用所学化学知识解决问题。
(1)下列食品中富含蛋白质的是(填序号,同下)。
①绿豆②苹果③牛肉④胡萝卜
(2)如图所示某品牌的食品包装袋上的配料,该配料中缺少人体所需的营养素是;该产品配料中能提供能量的是。
(3)厨房中常用下列物品,其中主要是利用有机合成材料制得的是。
①合成橡胶手套②棉布围裙③不锈钢炊具④塑料保鲜膜
(4)某些物质的近似pH为:柠檬汁为2.4、食盐水为7、肥皂水为10、烧碱溶液为13。旅游时若不小心被蚊虫叮咬(蚊虫能分泌出蚁酸),涂抹上述物质可以减轻疼痛。
(6 分)从Ca、C 、S、H、O 、N六种元素中选择适当的元素按要求填空。
(1)人体中元素含量最高的是 __________ ;
(2)常用作干燥剂的一种酸_____________;(填化学式,下同)。
(3)能作为燃料的有机化合物是__________:
(4)既可用来消毒杀菌,又可用来改良酸性土壤的碱是__________;
(5)造成煤气中毒的是__________。
(6)绿色植物进行光合作用吸收的是________________;
A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。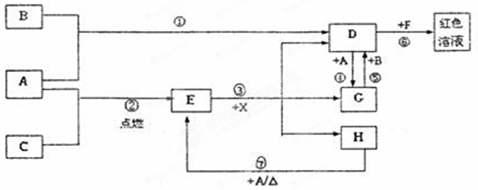
(1)写出下列物质的化学式:D X 。
(2)在反应①~⑦中,不属于氧化还原反应的是(填编号)。
(3)反应⑥的离子方程式为:。
(4)往G溶液中加入NaOH溶液观察到的现象是。
(5)反应⑦的化学方程式为;该反应中每消耗0.3mol的A,可转移电子mol。
(6)除去D溶液中混有的少量G的方法是:
(7)在D溶液中制备无水D的方法是:
(8)分别写出D溶液与小苏打溶液反应的离子方程式是:
甲乙两位同学分别用不同的方法配制100 mL 3.6 mol·L-1的稀硫酸。
(1)若采用18 mol·L-1的浓硫酸配制溶液,需要用到浓硫酸的体积为__________。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是________________________________。
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是__________________。
③定容的正确操作是___________________________________________________。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度线,处理的方法是________(填序号)。
| A.吸出多余液体,使凹液面与刻度线相切 |
| B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切 |
| C.经计算加入一定量的浓硫酸 |
| D.重新配制 |
(3)乙学生:用100 mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加水至100 mL刻度线,搅拌均匀,你认为此法是否正确?若正确,不用解释原因;若不正确,指出其中错误之处______________________ _ ______
_______________________。