在一个2L的密闭容器中,发生反应:2SO3(g) 2SO2(g)+O2(g) △H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g) △H>0,其中SO3的变化如图所示:
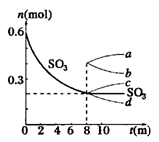
(1)写出该反应的平衡常数表达式_____________________。
(2)用O2表示0~8min内该反应的平均速率v="_______" 。
(3)升高温度,该反应的反应速率将________ ;K值将________;容器中气体的平均相对分子质量 将_________。(填“增大”“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是_______
a.v(SO3)=2v(O2)
b.容器内压强保持不变
c.v逆(SO2)=2v正(O2)
d.容器内密度保持不变
(5)从8min起,压缩容器为1L,则SO3的变化曲线为_______
| A.a | B.b | C.c | D.d |
取出的10mL溶液中,AlO2-的物质的量浓度为;
样品中Al的质量分数为(用小数表示,小数点后保留两位)。
该小组为了测定其中Al2O3的含量,从上面反应后的100mL溶液中,取出10mL溶液,逐滴加入1mol/L的盐酸,当滴到5.00mL时开始产生沉淀,继续滴加盐酸,至25.00mL时沉淀恰好全部溶解。
反应中产生的H2质量为___________________ g。
(本题共10分)
某实验小组利用如下图装置,测定某种旧铝合金(含Al2O3和其它不溶于NaOH溶液的成分)中Al的质量分数,其中100mLNaOH溶液过量,每隔相同时间读得电子天平的数据如下表: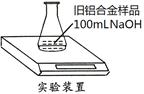
| 称量对象 |
读数次数 |
质量(g) |
| 样品 |
第1次 |
2.582 |
| 锥形瓶+100mL NaOH溶液 |
第2次 |
185.721 |
| 锥形瓶+NaOH溶液+样品 |
第3次 |
188. 286 |
| 第4次 |
188. 254 |
|
| 第5次 |
188. 243 |
|
| 第6次 |
188. 243 |
52.反应的化学方程式为。
第三组学生进行了两次滴定,消耗标准盐酸体积的数据如下表,其中第2次滴定后滴定管的读数如右图所示,将这一读数填入表中。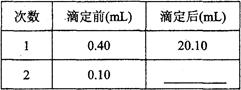

该组学生所测得的烧碱样品中NaOH的质量分数为__________________。