常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在pH=1的溶液中:K+、Na+、SO42–、HCO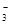 |
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO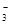 、SO42– 、SO42– |
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH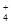 、I-、SCN- 、I-、SCN- |
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO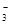 |
某温度下,对于反应N2(g)+3H2(g) 2NH3(g)ΔH="-92.4" kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g)ΔH="-92.4" kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的判断结论正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的判断结论正确的是( )
| A.反应速率a>b>c |
| B.达到平衡时A2的转化率大小为:b>a>c |
| C.若T2>T1,则正反应是吸热反应 |
| D.达到平衡时,AB3的物质的量大小为:c>b>a |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )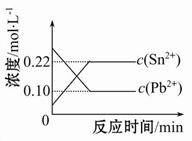
| A.往平衡体系中加入少量金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
下列叙述不正确的是( )
| A.化学平衡发生移动,平衡常数不一定发生变化 |
| B.升高温度会增大化学反应速率,其原因是增大了活化分子的百分数 |
C.某化学反应的能量变化如图所示,则该反应的ΔH>0,ΔS>0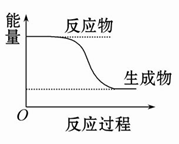 |
D.H3PO4的电离常数:  |
某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
| A.K越大,达到平衡时,反应进行的程度越大 |
| B.K随着温度的升高而增大 |
| C.K越小,达到平衡时,反应物的转化率越大 |
| D.K随反应物浓度的改变而改变 |