.欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
| |
开始沉淀的pH |
完全沉淀的pH |
| Fe(OH)2 |
7.0 |
9.0 |
| Fe(OH)3 |
1.9 |
3.2 |
| Cr(OH)3 |
6.0 |
8.0 |
(1)某含铬废水处理的主要流程如下图所示:
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示) 。
②请补充并配平以下反应池中发生主要反应的离子方程式:
Cr2O72-+ HSO3-+ == Cr3++ SO42-+ H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和 。证明Cr3+沉淀完全的方法是 。
(2)工业可用电解法来处理含Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是 ,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因
。
③若溶液中含有0.01mol Cr2O72-,则阳离子全部生成沉淀的物质的量是_______mol。
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用Al2O3+3C+N2 2AlN+3CO制取氮化铝,设计下图实验装置:
2AlN+3CO制取氮化铝,设计下图实验装置: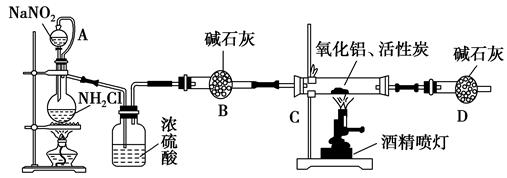
试回答:
(1)实验中用饱和NaNO2与NH4Cl溶液制取氮气的化学方程式为。
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是________(填写序号)。
a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是________________。
(4)化学研究小组的装置存在严重问题,请说明改进的办法________________。
(5)反应结束后,某同学用图装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。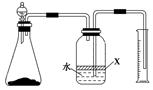
已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气。
①广口瓶中的试剂X最好选用________(填写序号)。
a.汽油b.酒精c.植物油d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将________(填“偏大”、“偏小”或“不变”)。
③若实验中称取氮化铝样品的质量为10.0 g,测得氨气的体积为3.36 L(标准状况),则样品中AlN的质量分数为________。
(共12分)
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
(1)第①步加稀H2SO4时,粗MnO2样品中的(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是
□+ □ClO3— + □= □MnO2↓ + □Cl2↑ + □。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、、。
已知蒸发得到的固体中含有NaClO3和NaOH,则一定还含有(写化学式)。
(4)用浓硫酸来配制本实验需要的稀硫酸,进行如下操作,其中会使所配溶液浓度偏高的是
A用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中
B定容时仰视
C用量筒量取浓硫酸时,读数时仰视
D容量瓶中有水,未进行干燥
(5)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224L CO2(标准状况下),则在第②步反应中至少需要mol NaClO3。
二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638 g·cm-3,遇水易分解,是一种重要的化工试剂,下图是氯气与硫在50~59℃时合成二氯化硫的实验装置。
(1)装置A中发生反应的化学方程式为:。
(2)装置B盛放的药品是,作用是;装置C盛放的药品是,作用是。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,这样做的目的是。
(4)F装置中干燥管内所盛物质是,一个作用是,还有一个作用是。
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义.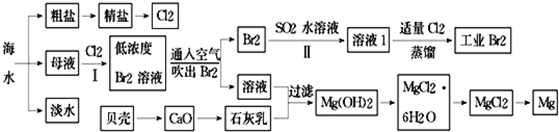
(1)氯碱工业主要以食盐为原料.为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是.
①过滤;
②加过量的NaOH溶液;
③加适量的盐酸;
④加过量的Na2CO3溶液;
⑤加过量的BaCl2溶液.
a.②⑤④①③b.①④②⑤③c.④②⑤③①d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是,所用主要仪器的名称是.
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是.
(4)步骤Ⅱ反应的离子方程式.
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产,请解释原因.
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用溶液进行洗涤除去.如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你(选填“同意”,“不同意”)该说法,理由是.
小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验.请回答有关问题.
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为,过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为.
(2)小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
则操作①的名称为,试剂A的化学式为.
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是(填化学式),试推测产生该白色沉淀的离子方程式是.