(共12分)
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是
□ + □ClO3— + □ = □MnO2↓ + □Cl2↑ + □ 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、 、 。
已知蒸发得到的固体中含有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)用浓硫酸来配制本实验需要的稀硫酸,进行如下操作,其中会使所配溶液浓度偏高的是
A用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中
B定容时仰视
C用量筒量取浓硫酸时,读数时仰视
D容量瓶中有水,未进行干燥
(5)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是______(填代号)。
a.浓硝酸 b.硝酸银 c.氯水 d.烧碱
(3)上述流程中可以循环使用的物质有.(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号)。
a.石灰石 b.稀HCl c.稀H2SO4 d.纯碱
(6)操作Ⅰ的名称是;操作Ⅱ根据KMnO4和K2CO3两物质在(填性质)上的差异,采用(填操作步骤).趁热过滤得到KMnO4粗晶体。
已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,Na3BiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的Na3BiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi元素在周期表中的位置;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为;
(3)实验④中的现象为:;
(4)实验②反应的离子方程式是:
;
(5)实验③反应的离子方程式是:_。
下图为实验室制乙烯(A)、硝基苯(B)和石油分馏(C)的装置: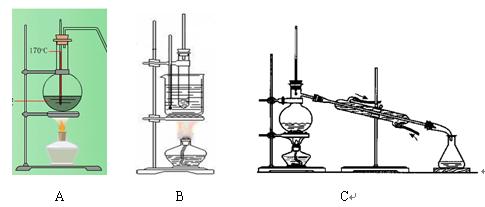
(1)在上述实验中,写出制取乙烯、硝基苯的化学方程式:
,
。
(2)在(填字母)实验中需加碎瓷片,其目的是。
(3)在石油分馏试验中,冷凝水的流向应是进出(填字母)
(4)实验室制乙烯时,有刺激性气味的气体产生,为消除其对乙烯性质实验的干扰,可将气体通过溶液除去。若反应没有及时升温至170℃,可能带来的主要副产物是(填名称)。
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢
化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。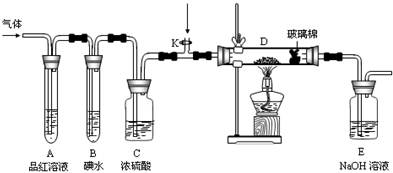
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒,当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下: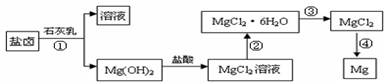
回答下列问题:
(1) 工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是
。
(2) 从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图: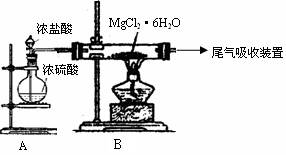
其中装置A的作用是 。
(4)写出过程④中发生反应的化学方程式 。