W、X、Y、Z是短周期中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X原子最外层电子数等于电子层数,Z元素的最高价氧化物的水化物的酸性是最强的。
(1)W位于元素周期表第______周期第______族。W的气态氢化物稳定性比 ______(填“强”或“弱”)。
______(填“强”或“弱”)。
(2)Y有两种常见的氧化物,能同时使溴水和酸性高锰酸钾溶液褪色的是 (写化学式),并写出这两个离子方程式:
_______________________________________________________________________
________________________________________________________________________
(3) 实验室制取Z的单质的化学方程式是:_______________________________________。
实验室制取Z的单质的化学方程式是:_______________________________________。



X的单质和FeO反应的热化学方程式是_________________________________________。
某火力发电厂以煤为燃料,充分燃烧后将热能转化为电能,其排出的废气中含有CO2、SO2、水蒸气等。为了检验该发电厂排出的废气中的成分,用如图所示的装置进行实验: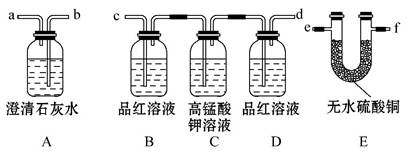
(1)仪器连接的顺序为(填导管接口字母) 。
(2)根据 现象能证明有SO2存在。
(3)根据 中无明显变化和装置A中
现象证明有CO2存在。
(4)把装置E放置在最后,能否证明该废气中含有水蒸气? ,理由是
。
(5)装置B的作用是 ,
装置D的作用是 。
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀盐酸中浸泡片刻,其目的是 。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称量;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 。
(4)B中发生反应的化学方程式为 。
(5)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得的质量分数将 (填“偏大”“偏小”或“不受影响”)。
某同学用如下图所示装置制取纯净的氧气。试回答下列问题:
(1)乙中Na2O2可能发生的反应有(写化学方程式)
。
(2)丙中NaOH溶液的作用是 ,
丁中浓硫酸的作用是 。
(3)若把原装置连接顺序改为甲→丙→丁→乙→戊,则在装置戊中能否收集到氧气? (填“能”或“不能”),原因是 。
某学校课外探究小组想利用过氧化钠以及下图所示的装置制取氧气并进行相关的实验探究。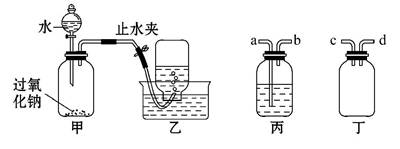
取适量Na2O2粉末放入广口瓶中,在分液漏斗中加入水,逐渐滴入到广口瓶中。用排水法收集气体。
(1)写出装置甲气密性检查的方法: 。
(2)写出装置甲中发生反应的化学方程式: 。
(3)收集气体时,可能会出现倒吸现象,为了防止大量的水进入装置甲中,可以在甲乙装置之间增加一个装置,该装置为 (从“丙、丁”装置中选取), (从“a、b、c、d”选取)连接装置甲的出气口。
(4)为了收集纯净的氧气,应该对题目给出的装置进行改进。请你叙述这种改进措施: 。
(5)某同学取上述实验得到的广口瓶内的溶液滴加在试管中,然后再滴入2~3滴酚酞试液,溶液变红,振荡试管,红色迅速褪去。
该同学通过查阅资料得知下列两个信息:
资料1:酚酞在c(OH-)为1.0×10-4mol·L-1~2.5 mol·L-1时呈红色,且0.5 min内不会褪色。
资料2:H2O2具有氧化性和漂白性。
由资料该同学认为“红色迅速褪去”是因为溶液中存在H2O2。试设计实验证明广口瓶内的溶液中含有H2O2,简述实验操作: ;设计实验证明H2O2溶液能够使滴有酚酞的稀NaOH溶液“红色迅速褪去”:
。
实验室常用Na2O2与H2O反应快速制取少量O2。用下面装置来制取O2并演示Na在O2中的燃烧实验。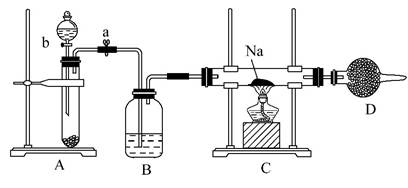
请回答下列问题:
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气 (填“漏气”“不漏气”或“无法确定”),判断理由是 。
(2)写出A装置中反应的化学方程式并标出电子得失情况:
。
(3)C装置中观察到的现象是 。
(4)D装置中盛放的试剂是 ,其作用是
。