某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀盐酸中浸泡片刻,其目的是 。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称量;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 。
(4)B中发生反应的化学方程式为 。
(5)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得的质量分数将 (填“偏大”“偏小”或“不受影响”)。
下图为实验室制取氨的实验装置。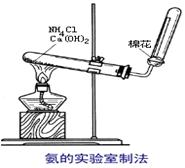
(1)写出A中所发生反应的化学方程式______________________________________________。
(2)该装置还可以制备哪种气体________。
(3)在收集氨时试管口棉花团的作用是。
(4)收集氨气应使用__________法,要得到干燥的氨气可选用__________作干燥剂.
下图中的实验装置可用于制取乙炔。请填空: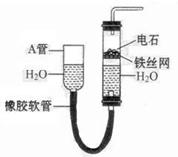
(1)图中,A管的作用是。
制取乙炔的化学方程式是。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是,乙炔发生了反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是,乙炔发生了反应。
(4)为了安全,点燃乙炔前应,乙炔燃烧时的实验现象是。
某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。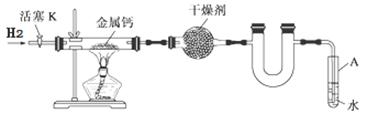
(1)试管A的作用有;。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
②;
③点燃酒精灯,进行反应;
④反应结束后,;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有胶头滴管、烧杯、玻璃棒、量筒、;
②判断滴定终点的方法是;
③产品中两种成分物质的量之比为。
(共14分)乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下: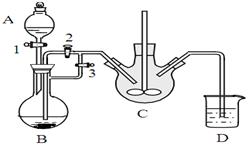
回答下列问题:
(1)NH4HCO3盛放在装置中(填字母),该装置中涉及的主要反应的离子方程式_
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。铁粉的作用是。反应结束后,无需过滤,除去过量铁粉的方法是_
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。滴定反应如下:
Ce4++Fe2+=Ce3++Fe3+
则产品中乳酸亚铁的质量分数为_
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是:、。
液体石蜡鼓泡瓶的作用是:。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是____ (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。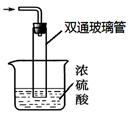
双通玻璃管的作用:;浓硫酸的作用:、。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为 _____。