《实验化学》
甲苯氧化法制备苯甲酸的反应原理如下: + 2KMnO4
+ 2KMnO4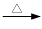
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O + HCl
+ HCl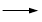
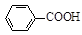 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。

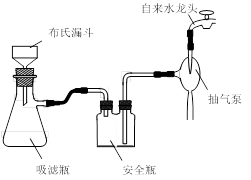
图1回流搅拌装置 图2抽滤装置
⑴实验室中实现操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 。
⑵如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 。
⑶在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是 ;如图2所示抽滤完毕,应先断开 之间的橡皮管。
⑷纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为 。
实验室用98%的浓硫酸(其密度为1.84 g/ml)配制100 mL
1.0 mol·L-1稀硫酸。
(1)需用10 mL的量筒量取浓硫酸的体积为mL。
(2)实验时选用的仪器有10 mL量筒、烧杯、玻璃棒、、。
(3)配制过程中,下列情况会使配制结果偏低的是(填序号)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.转移液体到容量瓶中时,未洗涤烧杯就定容
C.往容量瓶转移时,有少量液体溅出
D.容量瓶使用时未干燥
E.定容时俯视刻度线观察液面
(4)在容量瓶使用方法中,下 列操作正确的是(填序号)。
列操作正确的是(填序号)。
A.容量瓶用蒸馏水洗净后,再用待配液润洗
B.使用容量瓶前检查它是否漏水
C.将氢氧化钠固体放在天 平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
(4分)下图是实验室制取溴苯的装置:
导管a段的作用。反 应后不久导管b出口可见到白雾,导管b段末端跟锥形瓶里液面保持一段距离的目的是___________________。
应后不久导管b出口可见到白雾,导管b段末端跟锥形瓶里液面保持一段距离的目的是___________________。
1,2—二溴 乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于有机溶剂,在实验室中可以用下图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有酒精和浓H2SO4的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于有机溶剂,在实验室中可以用下图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有酒精和浓H2SO4的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
(1)写出实验中制备1,2—二溴乙烷的两个化学反应方程式,
。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象。
(3)容器c中NaOH溶液的作用是__________________________________。
实验事实:某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中结果得到蓝色沉淀。
Ι.甲同学认为:CuCO3是难溶解的物质,两者反应只有CuCO3一种沉淀生成;
乙同学认为: CO32-和Cu2+两者相互促进,发生水解反应,只生成Cu(OH)2一种沉淀;
丙同学认为:两种因素都有存在,应生成CuCO3和Cu(OH)2两种沉淀。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水].用离子方程式表示甲乙同学的观点
甲同学
乙同学
Ⅱ.在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为:①过滤②洗涤③干燥。
过滤除了使用铁架台、玻璃棒、烧杯外,还要用到的玻璃仪器是:_______;洗涤后的沉淀应____(选填下列序号)干燥:
A.在干燥管中 B.在U型管中 C.在干燥器中 D.在装有浓硫酸的洗气瓶中 E.在坩埚中微热
Ⅲ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
各装置连接顺序为A→C→B。装置C中装有试剂无水硫酸铜,若C中无水硫酸铜变蓝,澄清石灰水变浑浊,说明生成的沉淀的成分是:(写化学式)。
Ⅳ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。
⑴各装置的仪器连接顺序是(按照气体流向从左往右用字母表示)。
⑵ 若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为: (只列计算式)。
(6分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO  N2+3H2O+3Cu,用示意
N2+3H2O+3Cu,用示意 图中的装置制出氨气并在C中实现该反应。回答下列问题:
图中的装置制出氨气并在C中实现该反应。回答下列问题:
(1)A是实验室制氨气,发生反应的化学方程式是_________________
(2)实验检验氨气的方法是_______________________________ 。
(3)实验时C中反应,氨的作用是_____剂。(4) E中收集到的气体是______。
E中收集到的气体是______。