锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是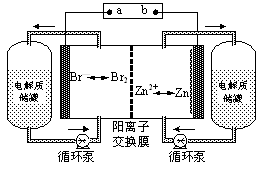
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
“环境问题”是当今全球共同关注的焦点,在哥本哈根气候大会上中国发挥了重要的作用。下列对环境造成危害的一组首要污染物是
| A.CO2、SO2、O2 | B.SO2、NO2、可吸入颗粒物 |
| C.CO2、N2、O2 | D.NO2、N2、可吸入颗粒物 |
高温下,某反应达到平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法不正确的是
。恒容时,温度升高,H2浓度减小。下列说法不正确的是
| A.该反应是焓变为正值 |
| B.恒温恒容下,充入更多的CO2,能提高H2的转化率 |
| C.升高温度,正、逆反应速率均增大 |
D.该反应化学方程式为:CO+H2O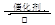 CO2+H2 CO2+H2 |
在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应:2R(g)+5Q(g) 4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
| A.1 | B.3 | C.4 | D.5 |
已知:NH2COO-+2H2O HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
| A.无法判断T1和T2的大小关系 |
| B.T1℃时,第6min反应物转化率为6.25% |
| C.T2℃时,0~6min ν(NH2COO-)=0.3mol·L-1·min-1 |
| D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是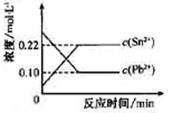
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25℃时,该反应的平衡常数K=2.2 |