【化学——选修2:化学与技术】
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)  H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示 H,则
H,则 H= ;
H= ;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两
个水分子产物,其结构式为 ,三聚
磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 ;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑ 请在答题卡上写出并配平反应式(a);
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;
原理上的不同点: ;
化学镀的优点: 。
有原子序数依次增大的五种短周期元素A、B、C、D、E,已知 A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y;A、B、C、E四种元素,每种元素都能与D元素形成原子个数比不相同的常见化合物,回答下列问题:
(1)B在周期表中的位置是, C元素的单质的电子式
(2)写出同时含A、B、C、D四种元素的一种盐的化学式
(3)E和D形成的一种化合物与BD2发生氧化还原反应,该反应的方程式为
(4)在一定条件下,一定量的A的单质与C的单质反应,可生成17克气体化合物CA3,同时放出46kJ的热量,写出该反应的热化学方程式
该反应为可逆反应,在体积不变的反应装置中,下列关于此反应的说法中正确的是
A.其它条件不变,加压可使该反应的反应速率变大
B.反应体系中反应物和生成物的总质量不变,说明该反应达到平衡状态
C.单位时间内生成1mol C的单质,同时消耗3molA的单质 ,说明该反应达到平衡状态
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,F为红棕色气体,H为黑色固体,B为白色沉淀。D、H都是常见的非金属单质。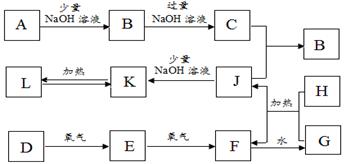
请回答下列问题:
(1)J的电子式为____________________。
(2)F的化学式为____________________。
(3)写出K加热生成L化学方程式:_____________________________________。
(4)写出B与过量NaOH溶液反应生成C的离子方程式:_______________________。
《化学与生活》
(1)人体健康与食品、药物等关系密切。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取(选填“脂肪”、“维生素”或“蛋白质”)不足引起的。
②生活中应合理地摄取人体必需的元素,体内元素含量过低,会引起甲状腺疾病。
③糖类、油脂、蛋白质都是人体必需的营养物质。其中糖类被摄入人体后,在酶的作用下最终水解为(写名称)。
④市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的离子方程式为。
⑤可以帮助流感病人解热镇痛的药物是(选填“青霉素”或“阿司匹林”)。
⑥淀粉溶液和蛋白质溶液都是胶体,用一束光通过其溶液,都产生现象,若用化学试剂检验它们,可用试剂;
(2)钙沸石CaAl2Si3O10•3H2O可写成氧化物的形式:
写出化学方程式:①在玻璃上雕刻花纹的反应原理是;
②明矾能净水的反应原理是;
③用氯乙烯制取聚氯乙烯。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。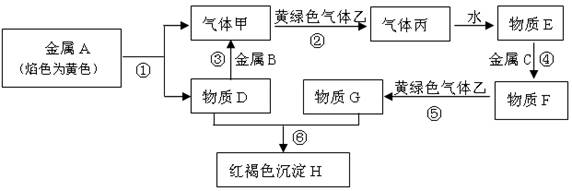
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: A_____、 B_____、C______。
(2)写出下列反应离子方程式:反应③________________;反应⑤_________。
(3)检验F溶液中阳离子的方法:。
金属钠在氧气中充分燃烧生成产物是色,将所得产物投入水中,产物和水迅速发生反应,写出该反应的化学方程式:。向上所得溶液中加入FeSO4溶液,看到的现象:,此过程中发生的氧化还原反应的化学方程式:。