有原子序数依次增大的五种短周期元素A、B、C、D、E,已知 A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y;A、B、C、E四种元素,每种元素都能与D元素形成原子个数比不相同的常见化合物,回答下列问题:
(1)B在周期表中的位置是 , C元素的单质的电子式
(2)写出同时含A、B、C、D四种元素的一种盐的化学式
(3)E和D形成的一种化合物与BD2发生氧化还原反应,该反应的方程式为
(4)在一定条件下,一定量的A的单质与C的单质反应,可生成17克气体化合物CA3,同时放出46kJ的热量,写出该反应的热化学方程式
该反应为可逆反应,在体积不变的反应装置中,下列关于此反应的说法中正确的是
A.其它条件不变,加压可使该反应的反应速率变大
B.反应体系中反应物和生成物的总质量不变,说明该反应达到平衡状态
C.单位时间内生成1mol C的单质,同时消耗3molA的单质 ,说明该反应达到平衡状态
甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH___1(选填>,<,=)。简要说明pH试纸的使用方法:
(3) 乙方案中,说明HA是弱电解质的现象是_________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
一定量的盐酸和过量的锌粒反应产生氢气,为了减慢反应速率,又不影响产生的氢气的总量,下列措施可行的是①加入NaOH固体②加入一定量的水③加入少量硫酸钠溶液④加入少量硫酸铜溶液⑤加入CH3COONa固体⑥加入KNO3溶液。
由金红石(TiO2)制取单质Ti,涉及到的步骤为:
已知:①
②
③
则(1) 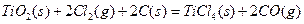 的
的 =________________。
=________________。
(2) 碳在氧气中不完全燃烧生成CO的热化学方程式为__________________________。
21、某同学设计用AlCl3溶液和Na2S溶液反应制取硫化铝(Al2S3)固体,你认为他能达到目的吗?原因是(用离子方程式表示):。配制Na2S溶液时,为了防止水解,常向溶液中加入少量,用离子方程式表示Na2S的水解。
减少SO2的排放、回收利用SO2是环保的重要课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下: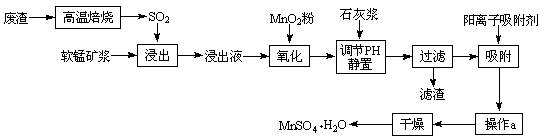
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其它金属离子。
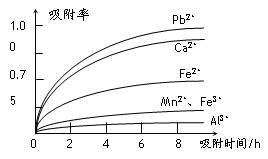
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |
已知PbO2的氧化性强于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式,
氧化过程中主要反应的离子方程式。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至范围,
滤渣的主要成分有 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是
(填写序号)。
a.溶液的pHb.金属离子的氧化性c.金属离子的半径d.吸附时间
⑷ 操作a包括过程。