减少SO2的排放、回收利用SO2是环保的重要课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下: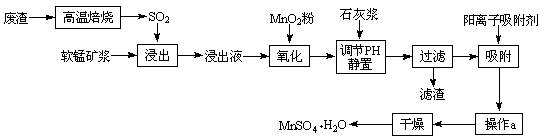
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其它金属离子。
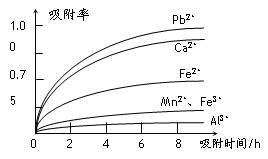
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |
已知PbO2的氧化性强于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式 ,
氧化过程中主要反应的离子方程式 。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至范围 ,
滤渣的主要成分有 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是
(填写序号)。
a.溶液的pH b.金属离子的氧化性 c.金属离子的半径 d.吸附时间
⑷ 操作a包括 过程。
(12分)为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1:2:3。
④用红外光谱仪处理该化合物,得到如图三所示图谱。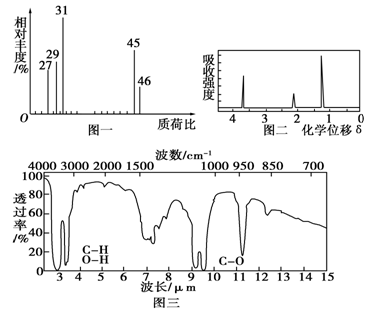
试回答下列问题:
(1)有机物A的相对分子质量是__________。
(2)有机物A的实验式是____________________。
(3)能否根据A的实验式确定A的分子式______(填“能”或“不能”),若能,则A的分子式是__________(若不能,则此空不填)。
(4)写出有机物A的结构简式______________。
【改编】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常作为有机溶剂,其中分子结构为正四面体的是________。
(2)聚氯乙烯是生活中常用的塑料。工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式为__________________________;
反应②的反应类型为________。
写出由氯乙烯制备聚氯乙烯的方程式_______________________。
0.2 mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2 mol。试回答:
(1)烃A的分子式为________。
(2)若取一定量的烃A完全燃烧后,生成B、C各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气________L。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为_____________________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为________________________;比烃A少2个碳原子的同系物有________种同分异构体。
【原创】请判断下列各组物质之间的关系(填“同位素、同素异形体、相同的物质、同系物或同分异构体”)
(1)1-已烯和环已烷 。
(2)新戊烷和2,2-二甲基丙烷_____。
(3) C和
C和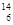 C 。
C 。
(4) 具有相同的通式。
【改编】降冰片烯化学名:双环[2.2.1]-2-庚烯,英文名称:Norbornylene,分子结构可表示为: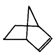
(1)写出降冰片烯中官能团的名称 。
(2)降冰片烯的分子式为 。
(3)降冰片烯中加入溴水现象 ,反应的化学方程式为 。
(4)降冰片烯不具有的性质
| A.能溶于水 | B.能发生氧化反应 |
| C.能发生加成反应 | D.常温常压下为气体 |
(5)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为 。