某地一辆满载浓硫酸的罐车翻倒,导致溶质质量分数为98%的浓硫酸25t泄漏,并向路基两边蔓延。接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请回答:
(1)溶质质量分数为98%的浓硫酸25t中含H2SO4的质量为 ;
(2)计算:中和泄漏的硫酸,理论上需要多少吨氢氧化钙?
实验室制取气体的常用装置如下图所示,根据所学的知识回答下列问题。
(1)写出装置中标号仪器的名称:①;②。
(2)实验室用高锰酸钾制取氧气,可选用的发生装置是(填字母)。写出该反应的化学方程式:。
(3)写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式:并据此选择上图中(填字母)组装一套制取干燥二氧化碳的装置。
(4)小明将实验室制取二氧化碳后的废液静置,取上层清液50g,向其中逐滴加入质量分数为26.5%的碳酸钠溶液。她根据实验测得的数据绘出下图,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是加入碳酸钠溶液的质量。试计算:
①50g废液中含氯化钙的质量;
②b点表示的溶液中氯化钠的质量分数。
现有Na2CO3和Na2SO4的固体混合物样品共12 g,将其溶解于92.4 g水中,向所得溶液中逐滴滴加H2SO4溶液,加入H2SO4溶液的质量与产生气体的的质量的关系如右图所示。求:
(1)固体混合物中Na2CO3的质量。
(2)求样品与H2SO4溶液恰好完全反应后所得Na2SO4溶液中
溶质的质量分数。
实验室现有500 g质量分数为98%的浓硫酸,其中溶质的质量是__________g。要将其稀释为10%的稀硫酸,需要加入水的质量__________g。
某小组利用下列实验数据,计算金属M的相对原子质量。已知金属M和硫酸反应的化学方程式为: M + H2SO4 ="=" MSO4 + H2↑。现取20 g该金属样品于烧杯中,然后向其中加入稀硫酸,实验数据记录如下: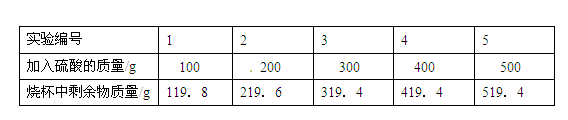
第5次实验后,烧杯中还有0.5 g剩余固体。
(1)原金属样品中M的质量
(2)计算该金属的相对原子质量。
(6分)在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:
取废液桶上层清液共11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示:
(1)通过右图可知,当碳酸钠溶液质量加到kg时,废液恰好处理完(盐酸与氯化钙的混合溶液完全转化成氯化钠溶液)。
(2)此时所得溶液能否用于该校生物兴趣小组的小麦选种(选种液要求氯化钠的溶质质量分数在10%~20%之间)?请通过计算回答。