某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
| 实验装置 |
实验步骤及操作 |
实验现象 |
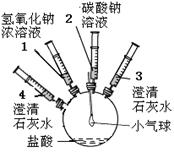 |
①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 |
气球变瘪 |
| ②将注射器3稍稍向外拉 |
澄清石灰水变浑浊 |
|
| ③将注射器1中的溶液推入瓶中 |
气球鼓起 |
|
| ④ |
无明显现象 |
|
| ⑤将注射器4中的溶液推入瓶中 |
|
(一)(1)步骤①中气球变瘪的原因 ;
(2)步骤①、②可得出碳酸钠具有 的性质;
(3)步骤④的操作是 ,其目的是 ;
(4)步骤⑤中发生反应的化学方程式 ;
(5)步骤③④⑤可得出碳酸钠具有 的性质;
(二)上述实验结束后,实验小组的同学又对瓶内溶液的成分十分好奇,进行了探究:
(1)【提出猜想】通过分析,一致认为瓶内溶液的溶质中一定含有 ,可能含有氢氧化钙或 。
(2)【实验验证】设计实验方案确定溶液中溶质的组成.
| 实验操作 |
实验现象 |
实验结论 |
| 分别取少量溶液于A、B两支试管中,A中 加入CaCl2溶液,B中加入Na2CO3溶液 |
A中产生白色沉淀,B中没有沉淀 |
瓶内溶液中溶质的成分为 |
(3)【反思与交流】根据所学化学知识,除了以上方案外,下列哪些物质可以代替试管B中加入的Na2CO3溶液完成该实验? (填序号)
a.K2CO3 b.BaCO3 c.CO2 d.无色酚酞 e. CuSO4
科学探究是奇妙的过程。在一次实验中,小明不小心把硫酸铜溶液滴加到了盛有5%H2O2的溶液的试管中,立即有大量的气泡产生。硫酸铜溶液中含有三种粒子(H20、SO2-、Cu2+),小明想知道硫酸铜溶液中的哪种粒子能使双氧水分解的速率加快。请你和小明一起通过下图所示的三个实验完成这次探究活动,并填写空白。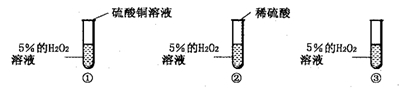
(1)你认为最不可能的是哪一种粒子,理由是____________________________。
(2)检验实验①产生的气体的方法是__________________________________。
(3)要证明另外两种粒子能否加快双氧水分解的速率,还需要进行实验②和③;
在实验②中加入稀硫酸后,无明显变化,证明_________不起催化作用;
在实验③中加入______后,会观察到大量的气泡,证明起催化作用的是_____。
(4)小明如果要确定硫酸铜是催化剂,还须通过实验确认它在化学反应前后_________。
发酵粉是一种制作风味糕点的常见蓬松剂。某兴趣小组拟对其化学成分进行如下探究。
【查阅资料】①发酵粉一般含有NH4HCO3、NaHCO3、明矾[KAl(SO4)2∙12H2O]中的2种。②已知反应:2NaHCO3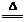 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【提出假设】假设1:有NH4HCO3和NaHCO3;
假设2:有NaHCO3和明矾;
假设3:有和明矾。
【方案与流程】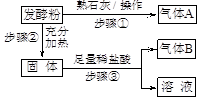
【问题与讨论】
(1)步骤①的操作是在研钵中把发酵粉和熟石灰混合、研磨。
(2)气体A为。若生成A,证明假设或假设可能成立;若不生成A,证明假设成立。
(3)如果生成A,经过步骤②和步骤③后,生成气体B,则B是(填化学式),证明假设成立,写出步骤②的化学方程式。
①实验室制取二氧化碳
结合下列实验装置图回答有关问题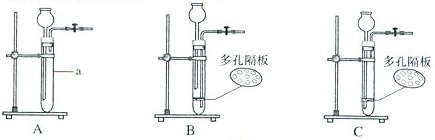
Ⅰ、仪器a的名称是________。
Ⅱ、用大理石和稀盐酸制取二氧化碳,反应的化学方程式是________。二氧化碳的收集方法是________。
Ⅲ、符合启普发生原理的装置是________(填编号)。
②制取二氧化碳后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质不溶于水且不参加反应):
甲、乙两同学分析认为剩余溶液中一定含有氯化钙,可能有盐酸。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钙溶液呈中性
| 实验操作 |
实验现象 |
结论 |
|
| 甲 |
取样于试管中,滴加________试液 |
试液变红 |
有盐酸 |
| 乙 |
取样于试管中,逐滴滴加碳酸钠溶液至过量 |
________ |
丙同学取样于试管中,滴加硝酸银溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,由此得出和甲、乙一致的结论。甲、乙认为丙的实验设计不合理。理由是________。
③从剩余溶液中得到尽可能多的氯化钙固体。
同学们认为加入稍过量的________(填化学式),经________、蒸发等操作后即可完成。
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠的热稳定性进行探究。
[查阅资料]碳酸氢钠受热易完全分解,生成水、二氧化碳气体和一种常见固体物质,该固体物质含有三种元素,且为纯净物。
[进行实验一]为了验证碳酸氢钠受热时会分解,该兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如图16所示。
加热一段时间后,观察小烧杯内壁有现象,证明有水生成;通过向烧杯中加入澄清石灰水证明有二氧化碳生成。
[提出问题]碳酸氢钠充分加热后固体产物是什么?
[作出猜想]猜想Ⅰ:固体产物是Na2CO3。
猜想Ⅱ:(请完成猜想Ⅱ)。
[进行实验二]下表是该兴趣小组同学设计的实验方案,用来检验碳酸氢钠分解后固体产物的成分,请你完成方案:
| 实验操作 |
预期实验现象 |
结论 |
| 有气泡冒出 |
||
| 取少量固体样品于试管中,加入足量盐酸 |
猜想Ⅱ结论正确 |
[拓展应用]碳酸氢钠常用来治疗胃酸过多,但对于患有胃溃疡(胃粘膜溃烂)的病人在胃酸(可用盐酸表示)过多时,却不宜服用碳酸氢钠,其原因是(用化学方程式表示)。
钢铁是使用最多的金属材料。在今年的化学活动周中,某校兴趣小组的同学在老师指导下做了二个有关铁的实验。
实验一:用干燥纯净的一氧化碳还原氧化铁
实验装置如下图:
其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是: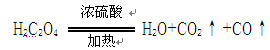 。请回答下列问题:
。请回答下列问题:
(1)B装置中发生反应的化学方程式是.
(2)C装置无明显现象,C装置的作用是。
D装置中浓硫酸的作用是 。
(3)E装置中的实验现象是。
(4)F装置的作用是、。
实验二:铝粉和氧化铁粉末反应(铝热反应)
实验装置如下图: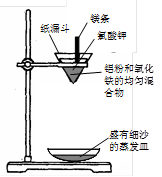
图中纸漏斗由两张滤纸折叠成漏斗状套在一起,使四周都有四层,点燃镁条后观察到的现象:镁条剧烈燃烧,发出耀眼的白光,放出大量的热,纸漏斗的下部被烧穿,有熔融物落入细沙中。
实验后老师作了如下提示:实验中镁条和氯酸钾的作用是提供反应所需的高温条件,铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,该反应常用于焊接钢轨。请写出该反应的化学方程式。该反应中单质铝与一氧化碳有相似的(填“氧化”或“还原”)性。
实验后同学们对金属与金属氧化物间的反应产生兴趣,激发了探究热情。
【提出问题】任何金属与金属氧化物在高温条件下都能反应吗?
同学们在请教老师后设计了如下实验方案并进行了探究。
【实验方案】
| 实验组别 |
实验操作 |
实验现象 |
结论 |
| 实验1 |
取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 |
黑色粉末变成色 固体部分溶解,有气泡产生,水溶液呈无色。 |
Zn和CuO能发生置换反应。 |
| 实验2 |
取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 |
发生爆炸,黑色粉末变成红色。 固体部分溶解,有气泡产生,水溶液呈色。 |
|
| 实验3 |
取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热。 |
粉末无变化 |
Cu、Fe2O3不能反应。 |
【实验总结】金属与金属氧化物在高温条件下有些能反应,有些不能反应。
【反思拓展】金属与金属氧化物在高温条件下反应的规律和金属与的反应相似。