6分)实验探究燃烧条件。
实验1 用棉花分别蘸酒精和水,在酒精灯火焰上加热片刻,
观察到蘸酒精的棉花燃烧而蘸水的棉花不燃烧。通过此实验说明
燃烧的条件之一是 。
实验2 如图进行实验,实验记录如下:
(1)白磷燃烧的化学方程式__________________________________;
(2)要得出“可燃物燃烧需要氧气”的结论,需要编号______和______的对比。
(3)若要使编号②铜片上的红磷燃烧,可采用的方法是_______________________________________。
| 编号 |
可燃物 |
现象(是否燃烧) |
影响因素 |
|
| 是否与氧气接触 |
温度是否达到着火点 |
|||
| ① |
铜片上的白磷 |
燃烧 |
√ |
√ |
| ② |
铜片上的红磷 |
不燃烧 |
√ |
× |
| ③ |
热水中的白磷 |
不燃烧 |
× |
√ |
小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂.于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣.
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验.
| 序号 |
KClO3的质量 |
其他物质的质量 |
温度 |
氧气的体积 |
反应所需时间 |
| ① |
2.0g |
330℃ |
100mL |
t1 |
|
| ② |
2.0g |
CuO 0.5g |
330℃ |
100mL |
t2 |
| ③ |
2.0g |
MnO2 0.5g |
330℃ |
100mL |
t3 |
| ④ |
2.0g |
MnO2 _________ g |
380℃ |
100mL |
t4 |
(1)若t1 _________ t2(填“>”、“=”、“<”),说明氧化铜能加快氯酸钾的分解速率.若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的 _________ 和 _________ 不变.
(2)你认为小雨设计实验③和实验②对比的目的是 _________ .
(3)实验④中MnO2的质量为 _________ g,若t3>t4,则化学反应快慢与温度的关系是 _________ .
(4)写出实验④所涉及的化学方程式 _________ .
某实验小组 利用如图装置测量空气中氧气体积分数并取得成功
【查阅资料】白磷着火点只有40℃.
【提出问题】氧气体积约占空气总体积的多少?
【实验准备】锥形瓶内空气体积为230mL,注射器中水的体积为50mL,该装置气密性良好.
【实验探究】装入药品,按图连好仪器,夹紧弹簧夹.先将锥形瓶底部放入热水中,白磷很快被引燃,然后将锥形瓶从热水中取出.
【现象分析】
(1)将锥形瓶底部放入热水中,白磷很快被引燃,说明燃烧不能缺少的一个条件是 _________ ,足量的白磷在锥形瓶中未能全部燃烧,说明瓶内剩余气体 _________ (填“支持”或“不支持”)燃烧.写出白磷燃烧的化学方程式 _________ ;
(2)在整个实验过程中,可观察到气球的变化是 _________ ;
(3)待白磷熄灭锥形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是:①注射器中的水自动喷出来,②当注射器中的水还剩下约4mL时停止下流.导致这些现象发生的原因是 _________ ; _________ .
【得出结论】氧气体积约占空气总体积的 .
.
某校化学研究学习小组的同学在一次活动中查阅资料时发现,单质碳能够在高温时与金属氧化物反应得到金属单质。于是,他们用木炭与CuO进行了如下的探究活动。请你参与他们的这次活动,并解决的关问题:
【提出问题】
木炭与氧化铜反应除生成单质铜外,另一种生成物是什么?
【猜想与假设】
(1)可能是CO。(2)可能是CO2。
【实验准备】
(1)他们在互联网上收集到这样一条信息:把滤纸浸泡在磷钼酸和氯化钯的黄色混合溶液中制成的试纸遇CO立即变成蓝色,而遇CO2不变色。
(2)CO2的检验方法是(用化学方程式表示)___________________。
【设计实验】如下装置图: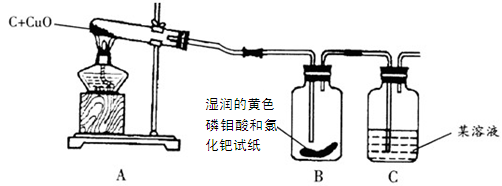
【实验与结论】
| 实验现象 |
实验结论 |
| A中固体由黑色变成红色 |
说明有________________生成 |
| B中黄色试纸没有变蓝 |
说明没有________________生成 |
| C中_________________________ |
说明有CO2生成 |
【反思与评价】
(1) 如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是____________。
(2)假设产生的气体是CO和CO2的混合气体,能否直接用点燃的方法来检验CO2?___(填“能”或“不能”),原因是_______________。
某同学做实验时发现,盛放NaOH溶液的瓶口与橡皮塞上,常有白色粉末出现。为探究这种白色粉末的成分,设计了如下实验。请你完成实验报告。
| 实验步骤 |
实验现象 |
结论和反应的化学方程式 |
1.  |
白色粉末溶 于水,形成 无色溶液。 |
|
2.  |
酚酞变红 |
溶液呈碱性,含有离子。 |
3.  |
溶液由红色变为 无色,并有气泡产 生。产生的气体使 燃着的木条熄灭。 |
溶液中还含有离子。 白色粉末中有氢氧化钠变质 生成的。产生气体 反应的化学方程式: 。 |
铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中: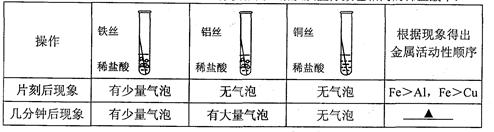
【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面的氧化物会先与盐酸反应。
【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是。
【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中: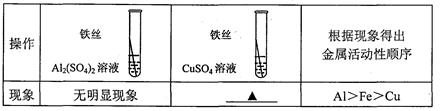
写出铁与硫酸铜溶液反应的化学方程式。
【拓展迁移】(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为。
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序。