C和Si分别是构成生命体和岩石的重要元素。
(1)CH4和SiH4沸点较高的是 。原因是 。稳定性较高的是 。
(2)SiC的晶体结构与晶体硅相似,其中C原子的杂化方式为 。微粒间存在的作用力是 。
(3)CO2形成的干冰晶体与SiO2晶体相比,下列说法不正确的有 。
A中心原子的杂化方式不同 B构成晶体的微粒种类不同 C晶体内微粒间作用力不同
D晶体导电性不同 E.常温时,晶体挥发性不同
(4)已知键能数据如下,化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。写出Si(s)在O2中燃烧生成SiO2(s)的热化学方程式 。
| 化学键 |
Si—O |
O=O |
Si—Si |
| 键能(kJ·mol-1) |
460 |
498 |
226 |
(5)氨基酸是构成蛋白质的物质基础,甘氨酸H2N-CH2-COOH中,各元素的电负性从大到小为 。
下列反应的离子方程式正确的有
| A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
B.电解饱和食盐水:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| C.氯气通入冷水中 Cl2 +H2O = Cl-+ClO-+2H+ |
| D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
下列说法正确的是:
| A.95℃时纯水的pH<7,说明加热可以使纯水呈酸性。 |
| B.25℃时,pH=12的某溶液中,由水电离出的c(OH-)一定为1×10-12mol/L。 |
| C.pH=3的醋酸溶液,稀释至10倍后pH=4。 |
| D.实验室通常将固态氯化铁溶解在盐酸中,再稀释到相应浓度来配制FeCl3溶液。 |
MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为:2H2+O22H2O,负极反应为:H2+CO32-→H2O+CO2+2e-。则下列推断中,正确的是()
| A.正极反应为4OH—→2H2O+O2↑+4e- | B.当电池生成1mol水时,转移4mol电子 |
| C.放电时CO32-向负极移动 | D.通H2的一极为负极,发生还原反应 |
其他条件不变的情况下,下列说法不正确的是:
A. 对于反应nA(g)+B(g)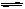 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
B. 对于反应2A(g)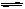 B(g)△H<0,若体系温度不再变化说明反应达到平衡状态。
B(g)△H<0,若体系温度不再变化说明反应达到平衡状态。
C. 对于反应2A(g)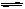 B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
D. 对于反应2A(g)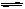 B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
某温度下,对于反应N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是:
2NH3(g)△H=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是: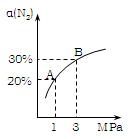
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。
B. 平衡状态由A变到B时,平衡常数K(A) <K(B) 。
C. 上述反应在达到平衡后,增大压强,H2的转化率提高。
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小。