(1)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示,
则该反应为 反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 |
C—H |
O—H |
C=O |
H—H |
| 吸收热量(kJ/mol) |
a |
b |
c |
d |
则该反应吸收或放出热量为 kJ(用含a b c d字母的代数式表示)
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生
CH4(g)+ 2H2O(g)  CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则 ① 前4s以H2O(g)浓度变化表示的平均反应速率为多少?②4s时,混合气体中H2的体积分数为多少?③ 平衡时,CH4的浓度是多少?
(要求:写出计算过程)
Ⅰ.①MgCl2②干冰③冰④Na2O2⑤白磷(P4)⑥硫磺⑦Na2CO3⑧金刚石⑨NaOH⑩SiO2
(1)以上物质中属于离子晶体的是;(2)属于分子晶体的是。(3)属于原子晶体的是______(均填序号)。
Ⅱ。下列物质中:(1)互为同分异构体的有;(2)互为同素异形体的有;(3)属于同位素的有;(4)属于同一种物质(分子组成相同)的有。(均填序号)
①液氯②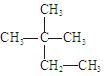 ③白磷④氯气⑤
③白磷④氯气⑤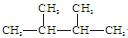
⑥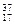 Cl⑦
Cl⑦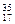 Cl⑧红磷
Cl⑧红磷
元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的 3/4 ,W-、Z+、X+的离子半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素。据此回答下列问题:
(1)W在元素周期表中的位置,实验室制取W单质的离子方程式是;
(2)A、B均由上述四种元素中的三种组成的强电解质,A是一种强碱,B是某种家用消毒液的有效成分,则A、B的化学式分别为、;
(3)C是由Y和Z两种元素组成的一种化合物,其中Y和Z的原子个数比为1∶1,则C的电子式是;
异甘草素具有抗肿瘤、抗病毒、抗自由基、抑制脂质过氧化等生物活性。异甘草素的合成方法如下:
已知:I有机物A的化学式为C7H8O,1H核磁共振谱图表明,它有四类谱,其比为3:2:2:1。
请回答:
(1)写出下列物质的结构简式A,D。
(2)写出B→C反应类型,步骤①在合成过程中的作用是。
(3)写出C经③与NaOH反应的化学方程式。
(4)B的同分异构体有多种,写出符合下列要求的2种同分异构体的结构简式、。
a.遇FeCl3溶液显紫色
b.能发生银镜反应
c.苯环上一氯取代产物仅有一种
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下:
请回答下列问题:
(1)根据反应原理,CO(NH2)2·H2O2分子内存在的作用力
是。
A.共价键 B.离子键
C.金属键 D.氢键
(2)流程图中反应器的装置如图所示,推测该反应的加热方式是 ;回流管中冷水流从口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是。
;回流管中冷水流从口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是。
(3)母液处理方案1可以是(用文字表达)。若欲从母液中离出H2O2和尿素,可采用的操作是 (选填序号)
(选填序号)
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(4)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称 取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至
取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至 滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式:MnO4-+H2O2+H +=MnO2++H2O+
+=MnO2++H2O+
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量。(“偏高”、“偏低”或“不变”)。
③根据滴定结果,可确定产品中活性氧的质量分数为。
燃油中所含硫以二硫醚的形式存在,工业上常用催化如氢的方法脱硫,然后综合利用生产硫酸。如二硫丙醚(C3H7-S-S-C3H7)脱硫综合利用的有关的应为:
C3H7-S-S-C3H7(g)+3H2(g)=2C3H8(g)+2H2S(g)△H1(反应1)
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)△H2<0(反应2)
2SO2(g)+O2(g)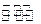 2SO3(g)△H3=-196kJ·mol-1(反应3)
2SO3(g)△H3=-196kJ·mol-1(反应3)
SO3+H2O=H2SO4
已知某些化学键的键能数据如下表:
| 化学键 |
C-C- |
C-H |
H-H |
S-H |
S-S |
S-C |
| 键能/kJ·mol-1 |
a |
b |
c |
d |
e |
f |
(1)则△H1=kJ·mol-1(用字母式表示)。
(2)反应2能自发进行的条件是。
(3)反应3的平衡常数表达式为:K=。既能提高SO2的转化率,又能加快反应速率的措施是。
(4)以硫酸作电解质的铅蓄电池,其充、放电原理可用下列化学方程式表示:
Pb+PbO2+2H2SO4 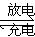 2PbSO4+2H2O
2PbSO4+2H2O
①放电时,硫酸的密度(填“增大”“减小”或“不变”)。
②充电时,阳极的电极反应式为。