下列有关晶体的说法中正确的是
| A.氯化钾溶于水时离子键未被破坏 |
| B.原子晶体中共价键越强,熔点越高 |
| C.冰融化时分子中共价键发生断裂 |
| D.范德华力越大,分子越稳定 |
下列说法中,正确的是()
| A.NH4+与HCO3-均可以水解,故NH4HCO3是弱电解质 |
| B.25℃时,l L pH=3的盐酸与1L pH=11的氨水能恰好中和 |
| C.25℃时,用广泛pH试纸测定出某醋酸溶液的pH=3.5 |
| D.25℃时,pH=14的溶液中,Na+、CO32-、K+、CIO-可以大量共存 |
下列关于砹(85At)及其化合物的说法中,正确的是( )
| A.稳定性:HAt>HCl | B.氧化性:At2>I2 |
| C.At2为分子晶体 | D.NaAt的水溶液呈碱性 |
将1 mol H2(g)和2 mol I2 (g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 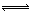 2HI(g);ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是 ()
2HI(g);ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是 ()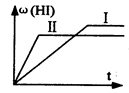
| A.恒温条件下,加入适当催化剂 | B.恒温,恒容下,充入氦气 |
| C.恒容条件下升高温度 | D.恒温,恒压下,充入氦气 |
A、B、C短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物x和y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )
①B与C均存在同素异形体 ②x的种类比y的多 ③常温下,B氢化物中无H+
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D.①④
设NA为阿伏加德罗常数的数值,下列说法错误的是()
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA |
| C.24 g NaH中阴离子所含电子总数为2 NA |
| D.标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA |