某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同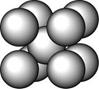
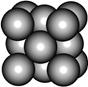
(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)左上图的的堆积方式为 , TK以下经测定其结构和性质参数如下表所示
| 金属 |
相对原子质量 |
分区 |
原子半径/pm |
密度/g·㎝-3 |
原子化热/kJ·mol-1 |
| Na |
22.99 |
s区 |
186 |
0.960 |
108.4 |
| A |
60.20 |
d区 |
r |
7.407 |
7735 |
则r= pm,试解释该晶体金属原子化热很高的原因
。
(已知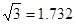 ,7.407≈
,7.407≈ ,1pm=10
,1pm=10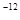 m)
m)
(4分)如右图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。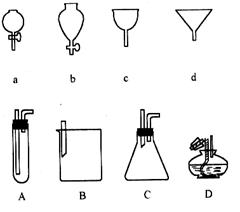
(1)A与c组合,用于;
(2)B与b组合,用于;
(3)B与组合,用于过滤;
(4)D与组合,用于向酒精灯中加酒精。
(13 分)有一包固体粉末,由CaCO3、Na2SO4、KCl、Ba (NO3)2、CuSO4中的三种物质组成,取样品进行如下实验:
(1)写出实验过程中发生反应的化学方程式:。
(2)固体粉末中一定不存在的物质是;一定存在的物质是;
(3)将固体粉末可能的组合填入下表:(可以不填满,也可以再补充。)
| 序号 |
化学式 |
| Ⅰ |
|
| Ⅱ |
|
| Ⅲ |
(4)请设计一个实验进一步确定混合物的组成,简述实验步骤、现象和结论。
在一定温度下,将2molN2和6molH2充入固定容积的密闭容器中,发生 N2(g)+3H2(g)2NH3(g),达到化学平衡后,若保持温度不变,令a、b、c分别为N2、H2、NH3的物质的量,重新建立平衡,混合物中个物质的量仍和上述平衡相同,填空
N2(g)+3H2(g)2NH3(g),达到化学平衡后,若保持温度不变,令a、b、c分别为N2、H2、NH3的物质的量,重新建立平衡,混合物中个物质的量仍和上述平衡相同,填空
(1)若a=0,b=0,则c="———"
⑵、若a=1, c =2,则 b =————
⑶、若a、 b 、 c取值必须满足的一般条件为(用两个式子表示,一个只含a和c,一个只含b和c )————————、 ————————。
向2L密闭容器中通入amol 气体 A和bmol气体B,在一定条件下发生反应;
已知:平均反应速率 ;反应2min 时,A的浓度减少了
;反应2min 时,A的浓度减少了 ,B的物质的量减少了
,B的物质的量减少了 mol,有a mol D生成。回答下列问题
mol,有a mol D生成。回答下列问题
(1)反应2min内,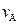 =,
=, ;
;
(2)化学方程式中,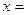 、
、 、
、 、
、 ;
;
(3)反应平衡时,D为2a mol,则B的转化率为;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的
0;(填“>”、“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率(填“增大”、“减小”或“不变”),理由是;
②平衡时反应物的转化率(填“增大”、“减小”或“不变”),理由是。
右图所表示在密闭容器中反应:2SO2(g)+O2(g)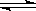 2SO3(g)ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是;b ~c过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c~d处.
2SO3(g)ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是;b ~c过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c~d处. 