中华人民共和国国家标准(GB2760-2011)规定葡萄酒中最大使用量为0.25。某兴趣小组用题9图1装置(夹持装置略)收集某葡萄酒中,并对含量碱性测定。

(1)仪器的名称是,水通入的进口为。
(2)中加入300.00葡萄酒和适量盐酸,加热使全部逸出并与完全反应,其化学方程式为。
(3)除去中过量的,然后用0.0900标准溶液进行滴定,滴定前排气泡时,应选择题9中图2中的;若滴定终点时溶液的=8.8,则选择的指示剂为;若用50滴定管进行实验,当滴定管中的液面在"10"处,则管内液体的体积(填序号)(①=10,②=40,③<10,④>40)
(4)滴定至终点时,消耗溶液25.00,该葡萄酒中含量为:。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施。
(8分)(2011·苏州模拟)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-六种离子。向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有________种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为________(填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是________(填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为
________________________________________________________________________、______________________________________________________________________。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为________。
(6)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为________________________________________________________。
(8分)实验室常用的几种气体发生装置如图A、B、C所示: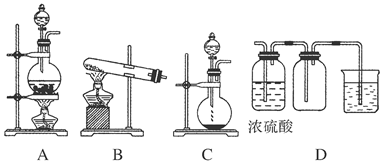
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是________;
检查C装置气密性是否良好的操作方法是________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
(8分)用如下图所示(夹持仪器省略)的装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
①下图中D装置在实验中的作用是__________________________________________;
②若A为浓盐酸,B为KMnO4,C为淀粉KI溶液,旋开E后,C中的现象为____________________,反应的化学方程式是______________________________________;
③若A为浓硫酸(70%),B为Na2SO3,C为酸性KMnO4溶液,旋开E后,C中的现象为________________________________________________________________________,
反应的化学方程式是_______________________________________________;
④若A为30%H2O2溶液,B为MnO2;C为H2S饱和溶液,旋开E后,C中的现象为________________________________________________________________________,
反应的化学方程式是__________________________________________________;
⑤若A为稀盐酸,B为大理石,C为Na2SiO3溶液,旋开E后,C中的现象为________________,反应的化学方程式是__________________________________;
⑥上图所示装置有多种用途,请举例(除题中之外):A为________,B为________,C中盛________,旋开E后,C中的现象为________________,反应的化学方程式是________________________________________________________________________。
(8分)化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:
(1)在盛放浓硫酸的试剂瓶的标签上印有如右图所示警示标志,说明浓硫酸是一种________。
(2)下列有关实验操作和安全事故处理错误的有________。
a.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉的广口瓶中
b.用试管夹从试管底由下往上夹住距管口约处,手持试管夹长柄进行加热
c.把用氯酸钾制氧气后的残渣倒入垃圾桶
d.给盛有液体的烧瓶加热时,需加碎瓷片或沸石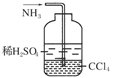
e.配制硫酸溶液时,在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
f.用右图所示装置吸收氨气
(8分)某同学用如图所示装置制取溴苯和溴乙烷。已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-119℃,密度为1.46 g·cm-3。
主要实验步骤如下:
①检查装置的气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处。
③将A装置中的纯铁丝小心向下插入混合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10 min。
请填写下列空白:
(1)步骤③中观察到的现象是_____________________________________________。
(2)导管a的作用是_______________________________________________________。
(3)C装置中U形管内部用蒸馏水封住管底的作用是
_______________________________________________________________________________________________________________________________________________。
(4)反应完毕后,U形管内的现象是____________________________________________;
分离溴乙烷时所用的最主要仪器的名称是(只填一种)____________________________。
(5)步骤④中能否用大火加热,理由是___________________________________。
(6)为证明溴和苯的上述反应是取代反应而不是加成反应,该同学用装置D代替装置B、C直接与A相连重新操作实验。
①装置D的锥形瓶中,小试管内的液体是________(填名称),其作用是________________;小试管外的液体是________(填名称),其作用是_________________。
②反应后,向锥形瓶中滴加________溶液,现象是__________________,其作用是____________________;装置D还可起到的作用是__________________________________。