(8分)某同学用如图所示装置制取溴苯和溴乙烷。已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-119℃,密度为1.46 g·cm-3。
主要实验步骤如下:
①检查装置的气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处。
③将A装置中的纯铁丝小心向下插入混合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10 min。
请填写下列空白:
(1)步骤③中观察到的现象是_____________________________________________。
(2)导管a的作用是_______________________________________________________。
(3)C装置中U形管内部用蒸馏水封住管底的作用是
_______________________________________________________________________________________________________________________________________________。
(4)反应完毕后,U形管内的现象是____________________________________________;
分离溴乙烷时所用的最主要仪器的名称是(只填一种)____________________________。
(5)步骤④中能否用大火加热,理由是___________________________________。
(6)为证明溴和苯的上述反应是取代反应而不是加成反应,该同学用装置D代替装置B、C直接与A相连重新操作实验。
①装置D的锥形瓶中,小试管内的液体是________(填名称),其作用是________________;小试管外的液体是________(填名称),其作用是_________________。
②反应后,向锥形瓶中滴加________溶液,现象是__________________,其作用是____________________;装置D还可起到的作用是__________________________________。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: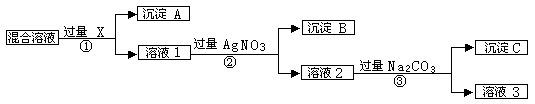
请回答下列问题:
⑴ 写出实验流程中下列物质的化学式试剂X:_______________ 沉淀A:_______________沉淀B:______________
⑵ 上述实验流程中加入过量的Na2CO3的目的是_______________________________。
⑶ 按此实验方案得到的溶液3中肯定含有_________________(填化学式)杂质。
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。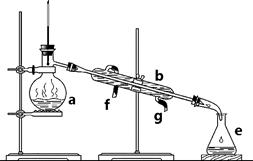
I II
⑴ 写出下列仪器的名称:a. ____________ b. _____________ c. ______________
⑵ 仪器a~e中,使用前必须检查是否漏水的有_______________。(填序号)
⑶ 若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是______________,将仪器补充完整后进行实验,温度计水银球的位置在_____________________处。冷凝水由________(填f或g)口通入,_________口流出。
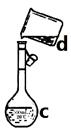
⑷ 现需配制0.1 mol/LNaOH溶液500 mL,装置II是某同学转移溶液的示意图。
① 图中的错误是________________________________________。除了图中给出的的仪器和分析天平外,为完成实验还需要的仪器有:_______________________________。
② 根据计算得知,所需NaOH的质量为_____________ g
③ 配制时,正确操作顺序是(字母表示,每个字母只用一次)__________________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
实验室要配制100mL 0.2mol·L-1的Na2CO3溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是
A.200mL容量瓶 B.量筒 C.胶头滴管 D.100mL容量瓶 E.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是___________和_ _________。
(3)容量瓶上除有刻度线外还应标有______和_____,在使用前必须检查容量瓶是否完好以及________________处是否漏水。(填容量瓶的受检部位)
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是
A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后再转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取Na2CO3固体___________克,若用4mol/L的Na2CO3浓溶液配制100mL 0.2mol·L-1的稀溶液,应用量筒量取__________mL该浓溶液。
某铝合金中含有单质铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验流程,请回答有关问题: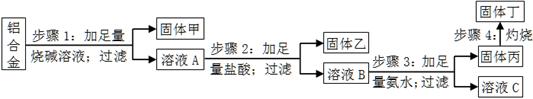
(1)步骤1所得固体甲的成分为。
(2)步骤2中加足量盐酸,而不采用通入足量二氧化碳的原因为。
(3)步骤3中生成固体丙的离子方程式为;溶液C中所含有的阳离子符号为。
(4)步骤4所发生反应的化学方程式为。
(5)现用托盘天平称取10.0g铝合金进行上述流程图所示操作,所得固体丁质量为15.3g,则该铝合金中铝的质量分数为;并判断以下操作对铝质量分数测定的影响(填“偏大”、“偏小”或“无影响”)。
a.步骤1中烧碱量不足,则;
b.步骤4中灼烧不充分,则。
氯化铝为白色的粉末,遇潮湿空气极易吸收水分并部分水解放出氯化氢而形成酸雾,在183℃升华。工业上由金属铝和氯气作用或用碳氯化法可制得无水氯化铝。某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝。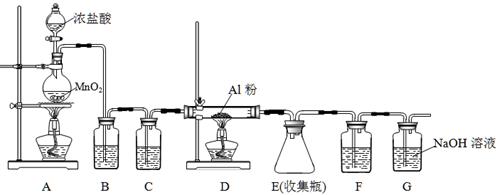
(1)装置A中用于盛装浓盐酸的仪器名称是,装置A可产生氯气和MnCl2溶液,该反应的化学方程式是。
(2)装置B中盛放饱和NaCl溶液,该装置的主要作用是。
(3)装置C、F均盛放浓硫酸,若取消装置C,则可能产生的不良影响是。
(4)装置D中预期观察到的现象是剧烈燃烧,发出白光,。
(5)另选一件仪器装入适当试剂后,也可起到F和G的作用,所装填的试剂名称为。
(6)工业碳氯化法制无水氯化铝是对氧化铝、碳和氯气进行加热,可得副产品一氧化碳,该反应的化学方程式是。