(15分) (1)某兴趣小组欲准确配制一定物质的量浓度的NaOH溶液:快速准确称取8.0 g 纯净的NaOH固体,配制成100 mL溶液,该NaOH溶液的物质的量浓度为 。所需的仪器除托盘天平、钥匙、小烧杯、玻璃棒外还缺少 。
(2)有机物X由C、H、O三种元素组成的,为确定其结构进行如下实验:
a.6.0 g X在一定条件下完全分解,生成3.36 L(标准状况下)一氧化碳和1.8 g水;
b.中和2.4 g 有机物X需消耗上述NaOH溶液20.00 mL;
c.0.1 mol有机物X完全转化为酯,需要乙醇9.2 g,0.1 mol X能与足量钠反应放出3.36 L(标准状况下)氢气。则:
①X的相对分子质量为 。
②X的分子式为 。
③写出X的结构简式: 。
④写X与足量乙醇发生酯化反应的方程式 。
中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是__________________。(写序号)
(2)选用的指示剂是 。(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。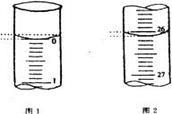
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|||
| 第二次 |
25.00 |
2.00 |
28.08 |
26.08 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(7)滴定终点的判定依据是 。
维生素C也称为抗坏血酸,是一种无色晶体,其水溶液显酸性,其化学特性是易失去电子,在水溶液中或受热时易被氧化。
[实验探究]
| 实验内容 |
实验现象 |
| 向2mL维生素C溶液中滴加2滴紫色石蕊溶液 |
溶液变为 色 |
| 将维生素C的溶液逐渐加入到2mL溶有淀粉的碘水中 |
溶液由蓝色变为无色 |
[问题思考]
①生的新鲜蔬菜比炊熟的蔬菜所含维生素C (填“高”或“低”)。
②维生素C可使食物中的Fe3+转化为Fe2+,这一过程体现了维生素C的 (填“氧化性”或“还原性”)。
③医生建议坏血病患者应多吃的食物是 (任举一种)。
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
(1)指出提取的过程中有关实验操作名称:① ;③ 。
(2)提取碘的过程中,可供选择的有机溶剂是 。(填字母序号)
A. 水、酒精 B. 四氯化碳、苯 C. 汽油、酒精
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,实验装置如图所示。
仪器A的名称为: 。指出装置
中的错误之处;① ;
② ;③ 。
实验室配制500mL0.1mol/LNa2CO3溶液。回答下列问题
(1) 用托盘天平应称取十水碳酸钠(Na2CO3·10H2O)晶体的质量为 。
(2) 用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的编号为(同一步骤可用多次): B→()→()→()→B→()→()→()。
A、调整零点
B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量
D、称量空的小烧杯
E、将砝码放回砝码盒内
F、记录称量结果.
(3) 本实验需用的主要仪器有
(4) 若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、定容时俯视刻度线
B、没有将洗涤液转入容量瓶
C、容量瓶内壁附有水珠而未干燥处理
下图为实验室某浓盐酸试剂瓶标签上的有关数据,请回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②在下列实验仪器中,配制时不必使用的是 (填字母)。
A 500mL容量瓶 B 250mL容量瓶 C 胶头滴管D 250mL烧杯 E 试管
上述实验中,还必须使用 ,它的作用是 。
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”、“偏小”或“无影响”)?
a.用量筒量取浓盐酸时俯视观察凹液面
b.定容时仰视刻度线