(5 分)海水中蕴含着 80 多种元素,海洋是一座巨大的宝库。氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产。所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域。
(1)氯碱工业中发生反应的化学方程式为:2NaCl + 2H2O=2NaOH + Cl2↑+A,则 A的化学式为 。氯气常用于自来水的杀菌消毒,它与水反应生成盐酸和次氯酸(HClO),试写出该反应的化学方程式 。
(2)下图是甲、乙两种固体物质的溶解度曲线。 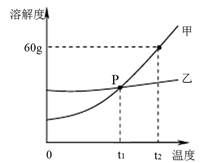
① P 点的意义是 。
② 甲物质中含有少量乙物质,提纯甲物质可用 方法(选填“降温结晶”、“蒸发结晶”之一)。
③ t2℃时,甲的饱和溶液中溶质的质量分数是 。
(4分) 某同学想通过实验判断家用的自来水是硬水还是软水。请填写下表中的空格,帮助其完成实验报告。
| 实验操作 |
现象 |
结论 |
| 原样品是硬水 |
||
| 原样品是软水 |
| 实验操作 |
现象 |
结论 |
| 取样后,加入少量肥皂水,振荡 |
可观察到有浮渣(或较少泡沫) |
原样品是硬水 |
| 只观察到有较多泡沫 |
原样品是软水 |
(12)现有以下仪器,请回答下列问题: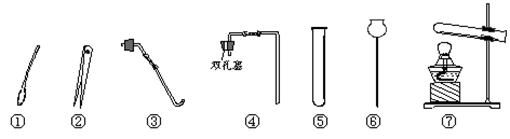
(1)仪器⑤的名称是;取用粉末状固体必须用到的仪器是(填序号)。
(2)如果用H2O2分解来制取氧气,制气装置最好选用仪器(填序号);这种装置还可以用来制CO2,其化学方程式为:,收集二氧化碳的方法为法。
(3)加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是。他不选用碳酸氢铵制取CO2的理由是。
(4)将(3)中制取二氧化碳的仪器装配好后,检验该装置气密性的操作方法。
(5)在⑤中收集满二氧化碳,倒扣于盛有水的烧杯中,一段时间后,⑤中液面_______(填“上升”或“不变”);理由。
(3分)下列实验操作中的先后顺序正确的是(选填合理选项的字母序号,答案并非唯一)。
| A.加热木炭和氧化铜的混合物检验气体产物,结束时先将导管从石灰水中移出,再熄灭酒精灯 |
| B.硫、红磷、铁丝在氧气中燃烧时,先往瓶中装满水,后引燃可燃物 |
| C.实验室制二氧化碳时.先向锥形瓶内添加石灰石,再向长颈漏斗内注入适量稀盐酸 |
| D.制取氧气时,先将导管伸入倒置于水槽中的集气瓶口.再加热盛氯酸钾和二氧化锰的试管 |
下图是与水有关的3个实验。
请回答下列问题:
(1)A中烧瓶里的水只发生了______变化(填“物理”或“化学”)。
(2)B中试管1内气体的化学式为________;B中反应的化学方程式为。
(3)“直饮水”的主要生产流程为:自来水→活性炭→超滤膜→紫外线→直饮水,其中超滤膜可以让水分子通过,其它大分子污染物则被截留。从原理上说,此流程中超滤膜的作用与实验C中的等材料是相同的。
碳元素的变化与我们的生活密切相关。
(1)下列碳单质的结构图示中,表示石墨的是(填编号)。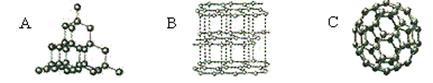
(2)煤燃烧时上方会出现蓝色火焰(如右图)是CO燃烧产生的。请用化学方程式表示此反应:;若在煤火上洒些氧化铜,会有铜生成。请用化学方程式表示此反应:。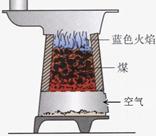
(3)二氧化碳是一种宝贵的碳氧资源,以下是固定二氧化碳的成功范。 例:
CO2+2NH3 CO(NH2)2 + X。此反应中物质X的化学式为;
CO(NH2)2 + X。此反应中物质X的化学式为;
若上述反应中,有44gCO2参加反应,则有g NH3参加了反应。
(4)现代文明追求“低碳生活”——指耗能尽量少,从而使碳特别是二氧化碳的排放量得以减低的生活。请举出一项“低碳生活”的具体行为:
。