化学式为C8H1018O的化合物A具有如下性质:
①A+Na→产生气泡 ②A+RCOOH→有果香味的产物
③A能使KMnO4酸性溶液褪色(被氧化为苯甲酸)
④A的催化氧化产物不能发生银镜反应
⑤A脱水反应的产物经聚合可制成一种塑料制品
(1)A中含氧官能团的名称是 ,性质⑤中脱水反应的反应类型是 。
(2)A的结构简式是 ,写出三种A的同分异构体的结构简式,它们均能与NaOH反应且苯环上的一溴代物均只有两种 。
(3)A与甲酸反应的方程式(必须注明18O的位置) 。
(4)A脱水后的产物发生聚合反应的产物的结构简式 。
通常用盛有饱和NaHCO3溶液的洗气瓶来除去混杂在CO2中的HCl气体,写出反应的化学方程式;不允许采用NaOH溶液的原因是(用离子方程式表示);也不允许采用饱和Na2CO3溶液的原因是(用离子方程式表示)
实验室用高锰酸钾和浓盐酸反应制取氯气:
KMnO4+HCl —Cl2↑+MnCl2+KCl+H2O
(1)配平上述的反应方程式,并标出电子转移的方向和数目(用双线桥)
(2)其中还原剂是_______。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是____mol。
(1)3.4克NH3含质子的物质的量为,该气体在标准状况下的体积是。
(2)已知500mL Al2(SO4)3溶 液
液 中含有Al3+为0.5mol,则Al2(SO4)3溶液的物质的量浓度为mol/L,取上述溶液50mL加水到150mL,此溶液中SO42-的物质的量浓度为mol/L。
中含有Al3+为0.5mol,则Al2(SO4)3溶液的物质的量浓度为mol/L,取上述溶液50mL加水到150mL,此溶液中SO42-的物质的量浓度为mol/L。
某元素同位素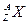 ,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
(1)Z值和A值;Z=;A=;
(2)X元素在周期表中的位置;
(3)根据已学知识推测,把X的单质放入水中反应的化学方程式为.。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E 这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:A;C_______
(2)画出D的离子结构示意图_____________,B在周期表的位置为。
(3)B的X2Y2型化合物结构式是_______,E的X2Y型化合物电子式为。
(4)B与D形成最高价化合物的电子式。
(5)C的氢化物和C的最高价氧化物的水化物反应生成M,M的化学式为,M中的化学键类型有__________________。