外围电子构型为4d55s1的元素在周期表中的位置是
| A.第4周期第ⅠB族 | B.第5周期第ⅠB族 |
| C.第4周期第ⅥB族 | D.第5周期第ⅥB族 |
关于强、弱电解质的叙述正确的是
| A.强电解质都是离子化合物,弱电解质都是共价化合物 |
| B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 |
| C.强电解质在水溶液中的电离是不可逆的 |
| D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是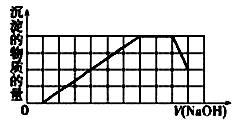
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1 |
| C.原溶液中一定含有SO42- 和Na+ |
| D.反应最后形成的溶液中溶质只有Na2SO4 |
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
| A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| B.加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
| C.c(Fe3+)=0.1mol·L-1的溶液:H+、Al3+、I-、SCN- |
| D.常温下pH=12的溶液:Na+、K+、SiO32-、NO3- |
以下物质间的转化通过一步反应不能实现的是
①.HCl→Cl2→HClO→NaClO
②.Na→Na2O2→Na2CO3→NaHCO3
③.Al→NaAlO2 →Al(OH)3→Al2O3
④.Si→SiO2→H2SiO3→Na2SiO3
⑤.S→SO3→H2SO4→Na2SO4
⑥.Cu→CuCl2→Cu(OH)2
| A.②③ | B.④⑤ | C.③④⑤⑥ | D.①④⑤ |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
| 选项 |
A |
B |
C |
D |
| X |
C |
Fe |
Ca(OH)2溶液 |
AlCl3 |
| W |
O2 |
HNO3 |
CO2 |
NH3·H2O |