X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y |
Y是地壳中含量最高的元素 |
| Z |
Z的基态原子最外层电子排布式为3s23p1 |
| W |
W的一种核素的质量数为28,中子数为14 |
| T |
常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P |
P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)TY2中心原子的杂化方式为_______;XY2中一个分子周围有__________个紧邻分子;堆积方式与XY2晶胞类型相同的金属有_________(从“Cu、 Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)Z的第一电离能比Mg的________(填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 。
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是 ,原因是 。
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T。已知:
① XO(g)+ 1/2O2(g)=XO2(g) ΔH="-283.0" kJ·mol-1
②T(s)+O2(g)=TO2(g) ΔH="-296.0" kJ·mol-1
此反应的热化学方程式是______________________________。
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方PT晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算)。
围绕下列七种物质:①铝、②Al2O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦Al2(SO4)3、⑧NaOH溶液,按要求回答下列问题:
(1)既能与强酸反应,又能与强碱反应的是_____________(填序号);
(2)属于电解质的是_____________(填序号);
(3)写出最适宜制取Al(OH)3的离子方程式_____________;
(4)两物质间发生反应的离子方程式为H++OH-=H2O,请写出该反应的化学方程式_____________;
(5)写出①和⑧反应的离子方程式________________________;
(6)34.2g⑦溶于水配成500mL溶液,则溶液中SO42-的物质的量浓度为_____________。
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇。
已知:25℃,101kPa下:H2(g)+ 1/2O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+ 3/2O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式______________________;
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下图所示: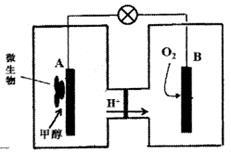
①电池外电路电子的流动方向为__________________(填写“从A到B”或“从B到A”)。
②工作结束后,B电极室溶液的酸性与工作前相比将_________(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
③A电极附近甲醇发生的电极反应式为______________ ;
(3)已知反应2CH3OH(g) CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol•L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:V正_________ V逆(填“>”“<”或“=”)。
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)= ______;该时间内反应速率V(CH3OH)=_____。
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g) CH3OCH3(二甲醚) (g)+CO2(g) △H<0,要提高CO的转化率,可以采取的措施是_______(填字母代号)
CH3OCH3(二甲醚) (g)+CO2(g) △H<0,要提高CO的转化率,可以采取的措施是_______(填字母代号)
a.分离出二甲醚b.加入催化剂c.充入He,使体系压强增大d.增加CO的浓度
e.再充入1molCO和3molH2
现有25℃时0.1mol•L-1的氨水,请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中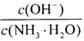 ______(填“增大”“减小”“不变”).
______(填“增大”“减小”“不变”).
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式______;所得溶液的pH_____(填“>”、“<”或“=”),用离子方程式表示其原因______;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)="a" mol•L-1,则c(SO42-)=______;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺是______;
(1)向含有AgI固体的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同)。
②若加入更多的AgI固体,则c(Ag+)________
③若加入固体AgCl,c(I-)________,而c(Ag+)________
(2)右图分别是量筒、滴定管的一部分,则:滴定管应该是_______(填编号),读数为_______mL(虚线标注处);
(3)室温下,甲溶液的pH是4,乙溶液的pH是5;甲溶液与乙溶液的c(H+)之比为_________;
按要求完成以下化学方程式:(是离子反应的只写离子方程式)
(1)铁在氯气中燃烧____________________________;
(2)将二氧化硫气体通入足量的澄清石灰水中__________________________;
(3)工业上氨在催化剂作用下与氧气反应__________________________;
(4)钠与硫酸铜溶液反应_______________、___________;