常温下,用0.1 mol·L-1的HCl溶液滴定a mL NaOH稀溶液。反应恰好完全时,消耗HCl溶液b mL,此时溶液中氢氧根离子的浓度c(OH-)是
| A.0.1b/a mol·L-1 | B.1×10-1 mol·L-1 |
| C.1×10-7 mol·L-1 | D.0.1b/(a+b) mol·L-1 |
将5.1gMg、Al合金溶解在过量的500mL2mol/L的盐酸中,然后加入4mol/LNaOH溶液。若要使生成的沉淀最多,则应加入的这种NaOH溶液的体积是
| A.200mL | B.250 mL | C.425mL | D.560mL |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
| A.1 mol乙烷分子中含有共价键总数为7NA |
| B.1 mol甲基(—CH3)所含的电子总数为9NA |
| C.标准状况下,22.4L苯完全燃烧耗氧分子数为8.5NA |
| D.1 mol丁烷被氯气完全取代时消耗的氯分子数为10NA |
 都具有氧化性,其氧化性
都具有氧化性,其氧化性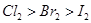 ,
, 能把溴从溴化物中置换出来,其余依次类推。向
能把溴从溴化物中置换出来,其余依次类推。向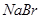 、
、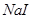 的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是
的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是
| A.NaCl | B.NaCl NaBr |
| C.NaCl NaBr NaI | D.NaCl NaI |
为了除去氯化钾中含有的少量硫酸镁和氯化钙杂质,需进行下列六项操作,先后次序正确的是:①加水溶解 ②加热蒸发得到晶体 ③加入过量的氢氧化钡溶液 ④加入适量的盐酸 ⑤加入过量碳酸钾 ⑥过滤
| A.①④③⑤⑥② | B.①⑤③④⑥② | C.①③④⑥⑤② | D.①③⑤⑥④② |
下列离子方程式正确的是
| A.将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:Al3++2SO42-+3OH-+2Ba2+=2BaSO4↓+Al(OH)3↓ |
| B.KMnO4与浓盐酸反应制Cl2:2MnO4-+16HCl=2Mn2++6Cl-+5Cl2↑+8H2O |
| C.0.1molCl2和100mL1mol/LFeBr2反应:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 |
| D.用Al(OH)3中和过多的胃酸:Al(OH)3+3H+=Al3++3H2O |