下列离子方程式中,正确的是
| A.碳酸钡与甲酸反应: BaCO3+2 H+ = Ba2++ CO2↑+H2O |
| B.足量NaOH溶液与NH4HS溶液反应:OH-+NH4+=NH3∙H2O |
| C.用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓ |
| D.硫酸型酸雨放置一段时间溶液的pH下降:2H2SO3+O2=4H+ + 2SO42- |
实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq) I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
下列说法正确的是
A.该反应的正反应为放热反应
B.A状态与C状态的化学反应速率大小为v(A)>v(C)
C.D状态时,v正>v逆
D.欲配制浓度较大的氯水,可将氯气通入氯化钾溶液中
下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
| 选项 |
微粒组 |
所加试剂 |
离子方程式 |
| A |
NH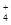 、Fe2+、SO 、Fe2+、SO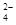 |
少量Ba(OH)2溶液 |
2NH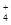 + 2NH + 2NH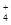 +SO +SO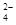 +Ba2++2OH- +Ba2++2OH-→ BaSO4↓+2NH3·H2O |
| B |
Mg2+、HCO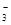 、Cl- 、Cl- |
过量NaOH溶液 |
Mg2++2HCO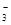 +4OH- +4OH-→ Mg(OH)2↓+2CO 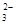 +2H2O +2H2O |
| C |
Fe2+、NO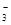 、HSO 、HSO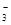 |
NaHSO4溶液 |
HSO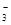 +H+→ SO2↑+H2O +H+→ SO2↑+H2O |
| D |
K+、NH3·H2O、CO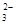 |
通入少量CO2 |
2NH3·H2O+CO2 → 2NH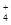 +CO +CO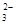 |
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
有关说法错误的是
| A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O → NaHCO3↓ + NH4Cl |
| B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 |
| C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 |
| D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出 |
某种氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数,下列说法正确的是
A.氯元素的相对原子质量是 |
B.m g该氯原子的物质的量是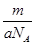 mol mol |
| C.该氯原子的摩尔质量是a NA g/mol | D.a g该氯原子所含质子数是17NA |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得 |
固体的质量为72g