(本题共16分)已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2的酸性溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出Bi在周期表中的位置 ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(3)实验④中的现象为: ;
(4)实验②反应的离子方程式是: ;
(5)实验③反应的离子方程式是:_ 。
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
第三周期中的半导体材料 |
| B |
L层s电子数比p电子数少1 |
| C |
第三周期主族元素中其第一电离能最大 |
| D |
前四周期呀中其未成对电子数最多 |
(1)B单质分子中,含有________个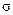 键和__________个
键和__________个 键,元素B的气态氢化物的空间型为________________。
键,元素B的气态氢化物的空间型为________________。
(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。
氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
 (1)某同学提出的假设是;
(1)某同学提出的假设是; (2)通过实验Ⅰ可以证明;
(2)通过实验Ⅰ可以证明; (3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入,再加入。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入,再加入。 (4)探究结果为。
(4)探究结果为。 (5)你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是。
(5)你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是。
根据下图所示实验回答下列问题:
 (1)试管C口部的棉团上发生反应的离子方程式是。
(1)试管C口部的棉团上发生反应的离子方程式是。 (2)试管B中的实验现象是,若将该试管中反应后的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。
(2)试管B中的实验现象是,若将该试管中反应后的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。 (3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是,如果浸NaHCO3溶液,则发生反应的化学方程式是。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是,如果浸NaHCO3溶液,则发生反应的化学方程式是。
某学习小组对教材实验“在200mL烧杯中放人20 g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15 mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究。




 (1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态。 同学们由上述现象推测出下列结论:
同学们由上述现象推测出下列结论: ①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③蔗糖炭化得到的碳连成整体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③蔗糖炭化得到的碳连成整体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性 其中依据不充分的是(填序号);
其中依据不充分的是(填序号); (2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
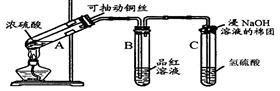
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
 试回答下列问题:
试回答下列问题: ①上图A中应选用下列装置(填编号)。
①上图A中应选用下列装置(填编号)。
 ②B装置所装试剂是;D装置中试剂的作用是
②B装置所装试剂是;D装置中试剂的作用是 ;E装置中发生的现象是;
;E装置中发生的现象是; ③A装置中使蔗糖变黑的化学反应方程式为;
③A装置中使蔗糖变黑的化学反应方程式为; ④F装置中酸性高锰酸钾溶液颜色变浅的原因是
④F装置中酸性高锰酸钾溶液颜色变浅的原因是 ;其反应的离子方程式是。
;其反应的离子方程式是。
研究性学习小组进行SO2的制备及性质探究实验。 (1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。
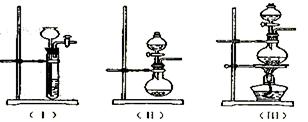
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。 ①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
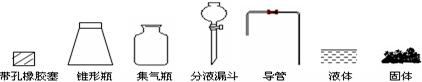
 ②实验过程中,使用分液漏斗滴加浓硫酸的操作是。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是。 (2)将SO2气体分别通入下列溶液中:
(2)将SO2气体分别通入下列溶液中: ①品红溶液,现象是;
①品红溶液,现象是; ②溴水溶液,现象是;
②溴水溶液,现象是; ③硫化钠溶液,现象是。
③硫化钠溶液,现象是。 (3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。 ①原因,验证方法。
①原因,验证方法。 ②原因,验证方法。
②原因,验证方法。 ③原因,验证方法。
③原因,验证方法。