(本题16分)三氧化二镍(Ni2O3)可用于制造高能电池。一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3。其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。右图为电解装置示意图,电解池两极用阳离子交换膜隔开。请回答下列问题: 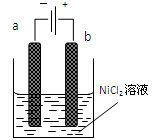
(1)该电解池的阳极材料可选用________(填序号)
| A.铁 | B.Cu | C.石墨 | D.镍 |
(2)加放适量硫酸钠的作用是:_______________________________________________
(3)电解过程中,阴极附近溶液的pH_____,阳极附近溶液的pH_____(填“升高”、“不变”、“降低”)。
(4)写出Ni2+转化为Ni3+的离子方程式:_______________________________________
(5)铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O 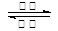 Fe(OH)2+2Ni(OH)2。
Fe(OH)2+2Ni(OH)2。
写出下列电极反应式:
①放电时的正极:___________________________________________________________
②充电时的阴极:___________________________________________________________
(6)电池充电时,电池的负极应接外电源的_____________(填正极或负极)
[化学——选修有机化学基础]
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
已知:R1-CH=CH-R2  R1-CHO+R2-CHO
R1-CHO+R2-CHO
(1)F的名称是___________,C中含有的官能团的名称是______________。
(2)③的反应条件是_________________________。
(3)写出下列有机物的类别:A______________,E_______________。
(4)写出下列反应类型:⑥_________________,⑨______________。
(5)写出⑩反应的化学方程式:。
(6)有机物B和I的关系为____________(填序号,多填扣分)
| A.同系物 | B.同分异构体 | C.都属于醇类 | D.都属于烃 |
[化学——选修物质结构与性质]
在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置;
D元素基态原子电子排布式为_____________________________。
(2)E的气态氢化物在同族元素中沸点最高的原因是:
。
(3)A、C两元素第一电离能>。(填元素符号)
(4)B元素能形成多种配合物。元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是的原子。
(5)A元素可与氢元素形成离子化合物,电子式为_______________;这种离子化合物可与水反应,化学方程式为________________________________。
[化学——选修化学与技术]
羟基磷灰石[Ca5(PO4)3OH]是一种一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5 Ca(NO3)2 + 3(NH4)2HPO4 + 4NH3·H2O = Ca5(PO4)3OH↓++
②5Ca(OH)2 + 3H3PO4 =
(2)与方法A相比,方法B的优点是。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
。
(4)图中所示3种钙盐在人体中最稳定的存在形式是(填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因。
(1)现有浓度各为1 mol/L的FeCl3、FeCl2、CuCl2的混合溶液100mL,加入一定量的铁粉,按下列情况填空:
①充分反应后铁粉有剩余,则溶液中一定含有__________阳离子,一定没有__________阳离子。有关反应的离子方程式是__________________________
__________________________________________________________。
②充分反应后铁粉无剩余,有铜生成。则反应后的溶液中一定含有_________阳离子;溶液中可能含有_________阳离子,该阳离子在溶液中物质的量的可能存在范围是: ______________________。
③充分反应后,无固体沉淀物存在,反应后的溶液中一定含有____和____阳离子。
(2)现有AlCl3和FeCl3的混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol。在此溶液中加入90 mL 4 mol / L的NaOH溶液,使其充分反应;设Al3+ 的物质的量与总物质的量的比值为x。
①根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是___________;物质的量是__________mol。
②计算沉淀中只有Fe(OH)3时的x的取值范围:_____________________。
下列图中A-F是中学化学常见化合物,且A﹑B﹑E﹑F均含有相同一种金属元素,G是一种常见单质。
①A(固体)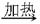 B + C + D②C + E → B + G;③ D + E → F + G
B + C + D②C + E → B + G;③ D + E → F + G
④A(溶液)+F(溶液)→B(溶液)+D⑤B(溶液) + C + D → A(溶液)
(1)写出A﹑B﹑C﹑E﹑F的化学式:A__________ B_________ C__________
E__________ F__________
(2)写出反应①②④⑤的化学方程式:
①_________________________________________________
②_________________________________________________
④_________________________________________________
⑤_________________________________________________
(3)请写出化合物E的两种重要用途:____________________________