学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取
FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)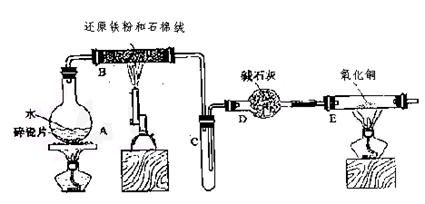
(1) 回答下列问题:所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为 (填序号)。
| A.稀盐酸 | B.氢氧化钠溶液 | C.浓硫酸 | D.FeCl3溶液 |
此步涉及反应的离子方程式为 。
(2)反应发生后装置B中发生反应的化学方程式是 。
D装置的作用: 。
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下: 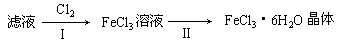
①用离子方程式表示步骤I中通入Cl2的作用 ②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。向一支装有该未 知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理 (填“合理”或“不合理”)。
人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
| 过程 |
思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ |
①根据氧化还原反应原理,一般物质有还原性,物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 |
②用离子方程式表示选择H2O2的原因 ③用离子方程式表示溶液变血红色的原因 |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 |
④选择铁粉的原因是(用化学方程式表示) ⑤为什么要用煮沸的水 |
| 4.实施实验 |
…… |
| …… |
…… |
(2)教材中实验方案如下:取2mLFeCl3溶液,加入少量铁粉,充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一试管中,再滴入几滴氯水,又发生了什么变化?学生通过实践证明,实验效果很差:没有预期的红色出现,而是很淡的浅红色,试分析实验中出现异常的可能原因并加以改进使实验现象更明显。
⑥可能的原因:
⑦改进措施:
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表: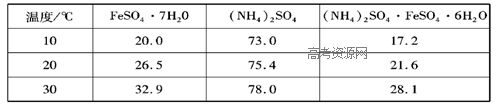
实验用品: Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇。
实验步骤流程图: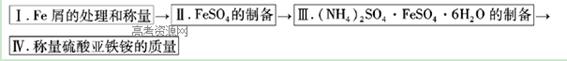
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用____________洗涤晶体。
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4·FeSO4·6H2O的质量分数?(列式计算)
CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究。
【提出假设】
假设1:沉淀为Cu (OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3·mCu (OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【定性探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设成立。
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是(填代号)。
a.浓硫酸 b.无水CuSO4 c.碱石灰 d.P2O5
(3)乙同学更换B试剂后验证假设3成立的实验现象是。
【定量探究】
(4)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是(双选,填代号)
| 溶解度(S)/g |
溶度积(Ksp) |
摩尔质量(M)/g·mol-1 |
|||
| Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
CaCO3 |
BaCO3 |
| 0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
100 |
197 |
a.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为54.2 g,实验结束后装置B的质量增加5.4 g,C中的产生沉淀的质量为39.4 g。则该蓝绿色固体的化学式为。
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
①检查装置的气密性,向装置图所示的U型管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小火加热,使其充分反应。
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为(生成的盐为NaHSO4):______________________。
(2)反应时若温度过高,可看到有红棕色气体产生,该气体化学式为__________。
(3)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(4)U型管内可观察到的现象是_____________________________。
(5)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_________________(填序号)
a.苯 b.H2O c.Na2SO3溶液 d.CCl4
所需的主要玻璃仪器是______________(填仪器名称)。
(6)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
铜陵有色股份有限公司电线电缆厂属国家电线电缆、绕组线行业专业生产厂。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。甲同学根据已学知识,提出了一套回收方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2 2CuSO4+2H2O ) ,于是他提出了另一套方案:
2CuSO4+2H2O ) ,于是他提出了另一套方案:
(1)甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
①;③。
(2)从环保角度对两套方案的不同部分进行比较,你认为(填“甲”或“乙”)方案更合理,理由是:。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是:。
丁又提出了疑问:如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?
请提出你的想法:。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。如果直接排放掉滤液,不仅造成了浪费,还会。
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸g,需水mL(水的密度为1.0g/mL ) ,在实验室中稀释浓硫酸时,是如何操作的:。