某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表(实验方案与实验现象没对应)
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生气体 |
| (C)剧烈反应,产生气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生的气体可在空气中燃烧,溶液变成浅红色 |
请你帮助该同学完成实验报告:
(1)实验的目的 。
(2)实验仪器:① ② ③ ④试管夹
⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为 (填字母编号)。实验现象
(A)为: 。
(4)实验结论 。
氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
⑴酸溶时,为了提高浸取率可采取的措施有。(写出一点)
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,通入Cl2发生反应的离子方程式:。
⑶加入试剂②的目的是调节pH至a,a的范围是;
为避免引入杂质离子,试剂②可选用。
| A.氨水 | B.氧化铜 | C.氢氧化铜 | D.氢氧化钠 |
⑷由溶液C获得CuCl2·xH2O,实验操作依次是加热浓缩、冷却结晶、过滤和洗涤等操作。加热浓缩过程需加入少量盐酸的目的是:。
⑸工业生产过程会产生含Cu2+的废水,向废水加入碱调节pH=8,沉降后废水中Cu2+浓度为mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亚铜(CuCl)也是一种重要的化工原料。
制备过程:向CuCl2溶液中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:。
在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接地获得。
⑴实验方法测反应反应热
①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要、。
为了减少实验误差:实验过程中将NaOH溶液(选填“一次”或“分多次”)倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式。
⑵通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H=kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g)△H=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+ O2(g) = H2O(g) △H=-241.8 kJ·mol-1
O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) △H=kJ·mol-1
(9分)现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。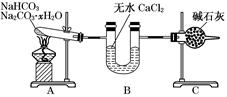
(1)A装置的作用是_________________________________________________________。
(2)B装置的作用是_________________________________________________________。
(3)C装置的作用是_________________________________________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为______。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________。为什么?________________________________________________________________________
________________________________________________________________________。
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.(1)乙同学的观点,你认为其原理是(用离子方程式表示):。
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。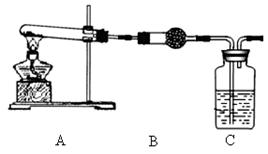
(3)B装置中试剂的化学式是,C装置中试剂的名称是。
(4)能证明乙同学观点正确的预期实验现象是。
(5)若丙同学的观点正确,用上述装置通过B、C中质量的增加来定量测定沉淀的组成,该装置存在的主要缺点是(任答1条即可)。
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
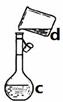
I II
⑴写出下列仪器的名称: a. c.
⑵若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是,将仪器补充完整后进行实验,温度计水银球的位置在处。冷凝水由(填f或g)口通入。
⑶现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:。
②根据计算得知,所需NaOH的质量为g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶;
B.准确称取经计算所需氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解;
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中;
D.将容量瓶盖紧,振荡,摇匀;
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切;
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处;
④下列哪个原因会造成所配溶液浓度偏高()
A.所用NaOH已经潮解 B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里未转移 D.称量时 “左码右物”
E.容量瓶中原有少量的蒸馏水 F.容量瓶盛过NaOH溶液,使用前未洗涤
G.定容时俯视刻度线
H. 定容后将容量瓶振荡,静置时发现液面低于刻度线,于是又加入少量水至刻度线