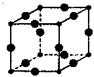
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。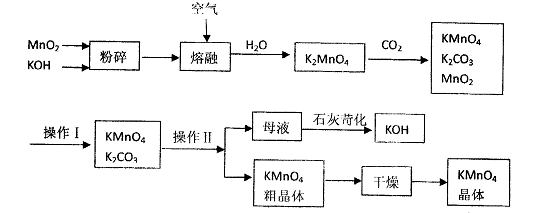
(1)上述流程中可以循环使用的物质有 、 (写化学式)。
(2)若不考虑制备过程中的损失与物质循环,则1 mol MnO2可制得 mol KMnO4;反应中二氧化锰的主要作用是 (“氧化剂”、 “还原剂”、“催化剂”)。
(3)操作I的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
(4)写出母液中加入生石灰苛化时的反应总的离了方程式 .
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代 号) 。
| A.石灰石 | B.稀HC1 | C.稀H2SO4 | D.纯碱 |
所需气体发生装置是 (选填序号)。
(1)将0.2mol/LHA(某一元酸)溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则此溶液中c(OH-)_______ c(H+), c(A-)_______c(HA);c(HA)+ c(A-)______0.1mol/L ;此溶液中由水电离出的c(OH-)______0.2mol/LHA溶液中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)将等体积pH=1的盐酸和醋酸,加入适量水,pH都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
(3)常温下,某酸 (A为酸根)与某碱
(A为酸根)与某碱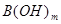 溶液恰好完全反应生成正盐,该溶液
溶液恰好完全反应生成正盐,该溶液 。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
(1)T的原子结构示意图是_______。用化学方程式表示冶炼T单质常用原理是________。
(2)与W同主族的某元素,其氢化物分子含有18个电子,该分子中存在的共价键的类型是__________。
(3)元素的非金属性:Q___W(填“强于”或“弱于”),用方程式简述其理由______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物。实验步骤:将盛有甲的试管倒扣在水槽中,____。
Ⅰ.乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:_________________________________。
(2)已知:
甲醇脱水反应 2CH3OHg) === CH3OCH3g) + H2Og)△H1="=" -23.9 kJ·mol—1
甲醇制烯烃反应 2CH3OHg) === C2H4g) + 2H2Og)△H2="=" -29.1 kJ·mol—1
乙醇异构化反应 C2H5OHg) === CH3OCH3g)△H3==+ 50.7 kJ·mol—1[来源:Z_xx_k.Com]
则乙烯气相直接水合反应C2H4g) + H2Og)=== C2H5OHg)的△H == __________________________。与间接水合法相比,气相直接水合法的优点是__________________________________。
Ⅱ. 甲醇虽然毒性很强,但它是一种清洁燃料,也是一种重要的合成原料。工业甲醇的质量分数可以用下列方法测定:
①在稀硫酸中甲醇被Cr2O72-氧化成CO2和H2O,其反应为:
CH3OH + Cr2O72— + 8H+====CO2↑+ 2Cr3++ 6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应,反应如下所示:
____Cr2O72— + ____Fe2+ +____H+――― ____Cr3++____Fe3+ +____H2O
现有0.12 g工业甲醇,在稀硫酸中与25.0 mL 0.2 mol/L K2Cr2O7溶液反应,多余的K2Cr2O7恰好与9.6 mL 1.0 mol/LFeSO4溶液完全反应。
(3)请配平第②步中离子方程式配平系数依次填写在短线上)。
(4)工业甲醇的质量分数为__________。
四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的3倍。
| 甲 |
乙 |
|
| 丙 |
丁 |
请用化学用语回答:
(1)丙在元素周期表中的位置是。
(2)丁单质的电子式是。
(3)乙的两种常见单质分别是、。
(4)甲、乙、丙、丁的气态氢化物水溶液显酸性的是、___________。
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是____________ (填化学式)。此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为。
(6)电解丙的饱和钠盐溶液的离子方程式为。
(7)若甲的元素符号为X。已知:①X2(g)+2O2(g)===X2O4(l) ΔH=-19.5 kJ·mol-1;
②X2H4(l)+O2(g)===X2(g)+2H2O(g)ΔH=-534.2 kJ·mol-1。
则液态X2H4和液态X2O4反应生成气态X2和气态H2O的热化学方程式为。
硼元素、钙元索、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用。
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl榕液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为。其在酸性溶液中不跪定,可发生歧化反应生成Cu2十和Cu,但CuO在高温下会分解成Cu2O,
试从结构角度解释高温下CuO为何会生成Cu2O:。
②CaC2中C22-与O22+互为等电子体.1molO22+中含有的π键数目为。
③乙炔与氢氰酸反应可得丙烯睛(H2C=CH一C≡N)。丙烯腈分子中碳原子轨道杂化类型是,构成丙烯腈元素中第一电离能最大的是(填元素符号)。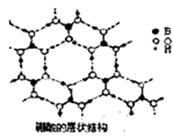
(2)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图〕.则1 mo1H3BO3的晶体中有mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少[B(OH)4]一和H+,则[B(OH)4]一含有的化学键类型为
(3)Cu3N的晶胞结构如图,N3-的配位数为。Cu+半径为a cm,N3-半径为bcm,Cu3N的密度为___g/cm3,(阿伏加德罗常数用NA表示)