A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称___ _____;B在周期表中的位置第 ______周期,第________族;
(2)A、B形成的化合物的电子式____ ____;
(3)C的元素符号________,C的最高价氧化物的化学式____ ____;
(4) D的最高价氧化物对应的水化物的化学式____ ____.
(7分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
|||||||||||||||||
| B |
C |
D |
E |
F |
G |
||||||||||||
| H |
I |
J |
K |
L |
M |
N |
|||||||||||
| O |
P |
||||||||||||||||
试回答下列问题:
(1)请写出元素P的基态原子电子排布式;
(2)画出元素E的电子排布图;F氢化物的分子构型
为;
(3)第三周期元素中,电负性最小的是(填元素符号);第一电离能最大的是
(填元素符号);
有机物的结构可用“键线式”简化表示,如:CH3-CH=CH-CH3可表示为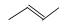 ,有一种有机物X它的键线式如下:
,有一种有机物X它的键线式如下: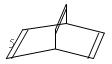
(1)X的分子式为:;有机物Y是X的同分异构体,且属于芳香族
化合物。则Y的结构简式是。
(2)Y可以与溴水反应,其生成物的结构简式是; Y在一定条件下
还可生成高分子化合物,写出该反应的化学方程式。
(6分)
(1)用系统命名法给下列有机物命名:
CH2=C(CH3)-CH(CH3)-CH3
(2)写出下列物质的结构简式:
反-2-丁烯;其分子中碳原子间形成的共价键共有个σ键个π键。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。请回答下列问题:
(1)电池的负极材料是;
(2)电池正极发生的电极反应为;
(3)组装该电池必须在无水、无氧的条件下进行,原因是;
(4)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,生成Na2SO3和NaCl。如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为。
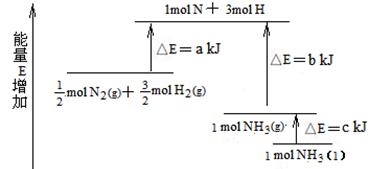
化学反应N2+3H2= 2NH3的能量变化如图所示,该反应的热化学方程式是:N2(g)+3H2(g) = 2NH3(l);⊿H =.