(15分)艾多昔芬(Iodoxifene)是选择性雌激素受体调节剂,主要用于防治骨质疏松症和乳腺癌,其合成路线如下(部分反应条件略去):
(1) 化合物I中含氧官能团的名称是________、________。
(2) 写出F→G的化学反应方程式:________________。
(3) 有机物C的结构简式为________。
(4) 写出同时满足下列条件的A的同分异构体的结构简式:____________。
① 能发生银镜反应;② 分子的核磁共振氢谱图中有4个峰;③ 能发生水解反应且产物之一遇FeCl3溶液能发生显色反应。
(5) 写出以甲苯和乙酸为原料制备有机物 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
H2C==CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
(4分)某温度时,2L容器中X、Y、Z三种物质的量随时间的变化如图所示。由图中数据分析,该反应的化学方程式为__;反应开始至2min ,Z的平均反应速率为。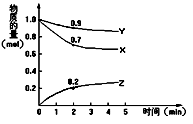
某微粒的结构示意图为 试回答:
试回答:
(1)当x-y=10时,该粒子为(填“原子”或“阳离子”“阴离子”)
(2)当y=8时,该粒子可能是(任写三种):、、。
(3)写出y=3的元素最高价氧化物与y=7的元素最高价氧化物对应水化物发生反应的
离子方程式。
根据要求回答下列问题:
①CaBr2②H2O③NH4Cl④H2O2⑤Na2O2⑥Ca(OH)2⑦HClO⑧I2⑨He⑩ Al
(1)只含有离子键的是(用序号回答)_________
(2) 含有共价键的离子化合物是(用序号回答)__________
(3)含有共价键的共价化合物是(用序号回答)________________
(4)常温时为固体,当其熔化时,不破坏化学键的是(用序号回答)________________
(5)熔融状态时和固态时,都能导电的有(用序号回答)_______________
写出下列物质的结构式
(1)CH4__________________(2)H2O_____________ (3)NH3_____________________
写出下列物质或微粒的电子式
(1) Ar(2)CO2(3) NaCl
(4 )KOH(5) N2(6)NH4+