(15分)某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应的装置.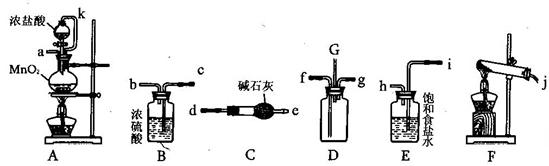
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是__________________
(2)装置E的作用是____________,橡胶管k的作用是________________________
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是__________________
(4)装置F中试管内发生反应的化学方程式____________________________________
(5)接入D装置的两根导管左边较长、右边较短,目的是______________________________
(6)整套装置从左向右的连接顺序是(j)接( ) ( )接(f) (g)接( ) ( )接( ) ( )接(a).
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: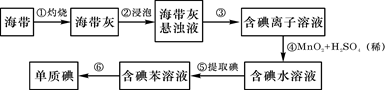
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(3)步骤④反应的离子方程式是。
此步操作还可以加入更合适的试剂是_________(从下面选择填代号);理由是___
____________________________________________________________________。
A、浓硫酸 B、新制氯水 C、酸化H2O2
(4)步骤⑤中,某学生选择用苯来提取碘的理由是。
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答: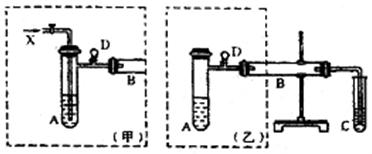
(1)两套装置中的A、B处都需加热,
A处用水浴加热,B处用 加热,A处用水浴加热的主要优点是 ;
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是 ,
B中反应的化学方程式为 。
(3)若按乙装置进行实验,则B管中应装 ,
(4)实验结束后,取C试管中的溶液滴入新制备的银氨溶液中并采用水浴加热可观察到有银镜生成,
写出该过程的化学方程式 。
(5)实验完成时先打开D处的铁夹,再撤去酒精灯,试说明这样做的目的是 。
为了证明化学反应有一定的限度 ,进行了如下探究活动:
,进行了如下探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_____________、___________。
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
| 实验操作 |
现象 |
结论 |
| 步骤一: |
产生蓝色沉淀 |
|
| 步骤二: |
“猜想二”成立 |
②写出操作“步骤一”中发生反应的离子方程式______________________
单晶硅是信息产业中重要的基础材料。通常在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃)四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
| 升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________。
(2)装置A中g管的作用是_ _____________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
_____________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?______(填 “是”或“否”),请说明理由__________。
②某同学称取5.000g残留物后,所处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气。某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下(部分导管、蒸馏水略):

(1)写出用Na2O2与浓盐酸制备氯气的化学方程式_________________________。
(2)下列装置组合最合理的是__________(填序号,需考虑实验结束撤除装置时残留有害气体的处理)。
| 组合 |
制备装置 |
净化装置 |
检验装置/试剂 |
尾气处理装置 |
| A |
③ |
② |
⑦/e |
⑤ |
| B |
③、⑥ |
① |
⑧/g |
① |
| C |
④ |
① |
⑤/e |
② |
| D |
④、⑥ |
⑤ |
⑧/g |
① |
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为:____________ 。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
① ___________________________________,② ___________________________________。
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?___________(填“是”或“否”);理由是__________________________________________ 。