仔细阅读给CuSO4·5H2O晶体加热过程中依次发生的如下反应:
CuSO4·5H2O CuSO4+5H2O,CuSO4
CuSO4+5H2O,CuSO4 CuO+SO3
CuO+SO3
4CuO 2Cu2O+O2,2SO3
2Cu2O+O2,2SO3 2SO2+O2
2SO2+O2
今取25.0 g CuSO4·5H2O晶体加热,使之均匀、缓慢升温至1000 ℃,并恒温1 h。请完成下列问题:
(1)最终所得固体的颜色为____________,质量为____________ g。
(2)不考虑实验带来的误差,在反应条件下,反应后的除去水后的气态产物的物质的量可能为____________(填写下列选项)。
A.0 B.0.1 mol C.大于0.1 mol
(3)(2)问中除上述三个选项外,你认为更准确的范围应该是什么?并予以说明。
(4)如果某同学做此实验时,最后固体质量为7.6 g,试通过计算判断该固体物质的组成,其物质的量各是多少?
某研究性学习小组的同学探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下: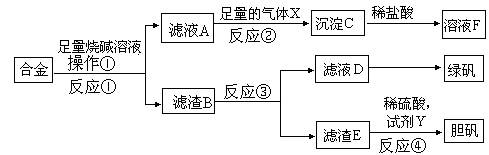
请回答:
(1)写出反应②的离子反应方程式__________________________________________。
(2)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是_____________________________________。
(3)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3•6H2O晶体,是将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3•6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是__________________
(4)丙同学设计如下方案测定甲同学所制得的绿矾晶体中结晶水含量,其方法过程如下
①称取mg己研细的新制得的绿矾晶体,称量的方法是___________
a.直接将晶体放置于天平托盘上所垫的纸片上称量
b.将晶体置于干燥的坩埚中,然后再按a中操作进行称量
c.将晶体置于己准确称量的干燥坩埚中,然后再按a中操作进行称量
②在氮气流环境中加热坩埚中晶体使其失去全部结晶水后再停止加热,并仍在氮气流环境下冷却。放在氮气流中加热与冷却的原因是____________________________
③将坩埚放在天平上进行称量,称得质量为n1g
④重复②、③的操作,称得的质量为n2g,表明不需要再加热再称量的依据是________
⑤下表数据来是该同学实验报告中的数据,试求出晶体中X=_______
| 实验编号 |
坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
| 1 |
11.2g |
25.1g |
19.2g |
| 2 |
11.2g |
25.1g |
18.8g |
| 3 |
11.2g |
25.1g |
18.9g |
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析,该同学改用图二的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快。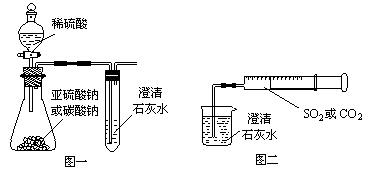
(1)若锥形瓶内装的是亚硫酸钠,写出锥形瓶内反应的化学方程式:______________
______________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是____________________________________。写出此时试管内发生反应的总化学方程式:____________________________________。
(3)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快,其原因是___________________________________________。
(4)用图一进行SO2与石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2,写出容器内发生反应的离子方程式:____________________。
重晶石填料的生产工艺流程为:

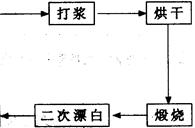
(1)在该流程中,为加快“漂白”速度,采取的措施有。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
。
(3)铝粉也起到了“漂白”的作用。你认为,铝粉是如何起到该作用的?
。
(4)有同学认为,既然两次水洗,那么铝粉的作用就不大。你的解释是:
。
(5)煅烧的主要目的是。
(6)将煅烧后的固体磨细,使用的是加有刚玉(氧化铝)球的振动磨。这说明刚玉具有很高的。
①电解池中电极反应的方程式是
阴极:,阳极:。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目。
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是,该反应能够进行的原因是。
④已知下列各物质的价格如下表:
| 物质 |
NaCl |
KCl |
NaClO3 |
KClO3 |
KOH |
| 价格(元/50kg) |
500 |
1900 |
4200 |
26000 |
10600 |
从经济效益分析,上述方法中的第种方法更好,理由是
。
5 Fe2+ +5C2O42—+3MnO4—+24H+="=5" Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有溶液的试管中,如,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
| a/g |
起始读数/mL |
b/mL |
c/mL |
| 0.1970 |
0.00 |
31.30 |
42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)==; n(C2O42—)==;
FeC2O4的质量分数为(精确到0.01%)