(10分)工业上以锂辉石( ,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①
②某些物质的溶解度( )如下表所示。
)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出A12O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤II中反应的离子方程式是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该固体做如下实验,所得现象和有关数据如下图所示(气体体积的数据均已换算成标准状况下的体积):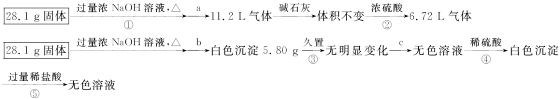
回答下列问题:
(1)混合物中是否存在FeCl2? __________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4?__________(填“是”或“否”);你的判断依据是______________________________。
(3)写出反应④的离子方程式______________________________。
(4)请根据计算结果判断混合物中是否存在AlCl3(说出你的判断依据,但不必写计算过程)______________________________。
金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子 的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定Ag++2CN-====[Ag(CN)2]-,终点时,溶液由黄色变成橙红色。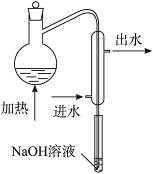
根据以上知识回答下列问题:
(1)水样预处理的目的是________________________________________。
(2)水样预处理的装置如图,细导管插入吸收液中是为了____________________。
(3)蒸馏瓶比吸收液面要高出很多,其目的是______________________________。
(4)如果用盐酸代替磷酸进行预处理,实验结果将__________(填“偏高”“无影响”或“偏低”)。
(5)准确移取某工厂污水100 mL,经处理后用浓度为0.010 00 mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00 mL。此水样中含氰化合物的含量为__________ mg·L-1(以CN-计,计算结果保留一位小数)。
)有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成。
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生。
③取少量②的溶液滴入稀硫酸,有白色沉淀生成。
④另取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。
(1)根据上述实验现象,判断原白色粉末的组成成分是(写名称)__________。
(2)写出实验步骤①和④中有关化学反应的方程式:______________________________。
下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。
(1)调整天平零点时,若指针偏向左边,应将右边的螺丝帽__________(填“向左”或“向右”)旋动。
(2)溶解样品时要用到玻璃棒,其作用是______________________________。
(3)反应生成沉淀的离子方程式为______________________________。
(4)加热蒸发过程中要用到玻璃棒,其作用是______________________________。
(5)过滤中要用到玻璃棒,其作用是______________________________。
(6)洗涤沉淀的目的是__________________________________________________________;
洗涤沉淀的方法是_______________________________________________________________;
为了检验沉淀是否洗涤干净,应在最后一次的洗涤液中加入__________溶液。
(7)最后一步操作中也要用到玻璃棒,其作用是______________________________。
Na2CO3是一种重要的化工原料,某学生甲拟在实验室中测量Na2CO3的纯度。他利用图1中给出的仪器设计了如图2所示的装置(本题装置图中所用塞子均未画出;杂质不参与反应),其中M容器中盛有Na2CO3样品10.0 g,分液漏斗盛有稀硫酸,N容器内为碱石灰固体。他利用碱石灰的增重来求算Na2CO3的纯度。

图1 图2
(1)学生乙认为,按学生甲设计的装置进行实验,存在明显缺陷,其中导致测定结果偏低的是__________。
(2)学生乙对学生甲设计的实验装置进行了完善(如图3)。实验室中可供选择的药品:Zn、浓硫酸、稀硫酸、NaOH溶液、碱石灰、CaCO3、水。请回答下列问题: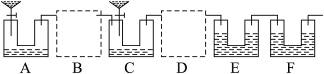
图3
①B、D虚框内是否需要添加装置,若需要,在相应虚框内画出装置图(并注明药品);若不需要,在相应虚框内打“×”;
②A装置中分液漏斗内液体为__________;U形管内药品为__________;装置F的作用为__________;
③如果B、D内部不设计任何装置而直接连通ACE,则实验结果将__________(填“偏高”“偏低”或“无影响”);
④如果实验后E装置质量增重3.96 g,则该Na2CO3试样的纯度为__________。