金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子 的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定Ag++2CN-====[Ag(CN)2]-,终点时,溶液由黄色变成橙红色。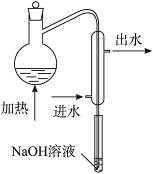
根据以上知识回答下列问题:
(1)水样预处理的目的是________________________________________。
(2)水样预处理的装置如图,细导管插入吸收液中是为了____________________。
(3)蒸馏瓶比吸收液面要高出很多,其目的是______________________________。
(4)如果用盐酸代替磷酸进行预处理,实验结果将__________(填“偏高”“无影响”或“偏低”)。
(5)准确移取某工厂污水100 mL,经处理后用浓度为0.010 00 mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00 mL。此水样中含氰化合物的含量为__________ mg·L-1(以CN-计,计算结果保留一位小数)。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)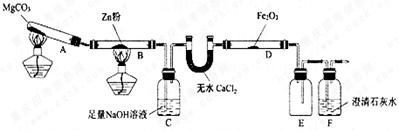
(1)MgCO3的分解产物为。
(2)装置C的作用是,处理尾气的方法为。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是。
②甲组步骤1中反应的离子方程式为。
③乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因及其验证方法为。
④从实验安全考虑,题9图装置还可采取的改进措施是_____________________________。
(14分)氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式。
(2)装置a中应放试剂为,其作用为;装置c为何水平放置;
(3)该实验的操作顺序应为(用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)f装置中应放置的试剂为 ,其作用为。
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在中,再加水稀释,这样操作的目的是。
(2)装置C的作用是。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、、自然干燥,在这一系列操作中没有用到的仪器有(填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式;
②请设计实验方案检验有Fe2+生成;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法(填“合理”或“不合理”),理由是。
(5)能表明I-的还原性弱于SO2的现象是。
Ⅰ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液法 B、渗析 C、结晶法 D、分液法 E、蒸馏法 F、过滤法
(1)分离饱和食盐水和沙子的混合物
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)分离水和苯的混合物
(4)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶。
Ⅱ.(1)指出下图装置中A、B的名称
AB
(2)分液操作中用到的主要仪器是。
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+8H2O(l) ΔH<0
一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化,所用注射器的容积充裕):
| 实验序号 |
A溶液 |
B溶液 |
| ① |
20 mL 0.1 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
| ② |
20 mL 0.2 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
(1)该实验探究的是因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是:<(填实验序号)研究发现反应速率总是如图所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②。
(3)若实验①在4 min末收集了4.48 mL CO2(标准状况),则4 min末c(MnO4-)=mol·L-1(假设溶液混合后体积为50 mL),此4 min内的平均速率为v(H2C2O4)= 。
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定来比较化学反应速率。