某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| |
实验步骤 |
预期现象与结论 |
| 步骤1 |
取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 |
|
| 步骤2 |
取少量步骤1中滤液于试管中, |
|
| 步骤3 |
取少量步骤1中滤液于试管中, |
|
步骤1中加入足量1mol/L CuSO4溶液的作用是 。
(4)固体产物中铁元素的质量分数的测定可采用下图的流程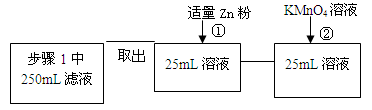
其中步骤①是向溶液中加入锌粉至黄色刚好消失;步骤②用0.010 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液平均为v mL。(已知5Fe2++MnO4- +8H+==5Fe3++Mn2++4H2O)
其中加入锌粉的目的是____ ____。
实验测得ag样品中固体产物铁元素的质量分数为____ __ _(只列计算表达式)。
可用如图所示装置制取、净化、收集的气体是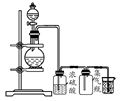
| A.锌和稀硝酸反应制一氧化氮 |
| B.亚硫酸钠与浓硫酸反应制二氧化硫 |
| C.铁和稀硫酸反应制氢气 |
| D.浓氨水和生石灰反应制取氨气 |
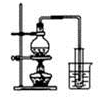
下列实验方案正确且能达到相应实验预期目的的是
 |
 |
 |
 |
| A.制取少量蒸馏水 |
B.制取少量NO2 |
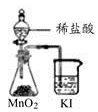
C.比较MnO2、Cl2、I2的氧化性 |
D.探究NH4HCO3的热稳定性 |
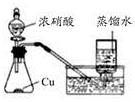
下列药品和装置合理且能完成相应实验的是

| A.喷泉实验 |
| B.实验室制取并收集氨气 |
| C.制备氢氧化亚铁 |
| D.验证苯中是否有碳碳双键 |
菠菜营养丰富,长期以来民间流传着“菠菜不能与豆腐同食”的说法。某学校化学兴趣小组的同学拟通过实验探究:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4·2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体。
他们设计的实验步骤如下:
1.将菠菜在少量开水中煮沸2~3 min,冷却后滤去菠菜,得滤液(含有少量 杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
2.用草酸晶体(H2C2O4·2H2O)做以下实验:
请回答以下问题:
(1)步骤1中加入CH3COOH溶液的作用:。
(2)A处应选择(填“Ⅰ”或“Ⅱ”),在做实验之前,应先。
(3)实验2过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中草酸晶体(H2C2O4·2H2O)发生反应的化学方程式:,装置B的作用是。
(4)为使实验结论更加严密和安全,在以上所连接的装置C、D间还需依次添加装有、、(液体试剂)的洗气瓶,此外指出上述装置中的不足之处还有。
一定浓度NaHCO3溶液与CuSO4溶液反应后生成了蓝绿色颗粒状沉淀。就沉淀成分提出了如下三种假设:
假设一:沉淀是CuCO3;假设二:沉淀是Cu(OH)2;
假设三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)写出假设二,沉淀是Cu(OH)2生成的理由(用离子方程式表示);
(2)为了探究沉淀的成分,取出了一部分沉淀,滴加稀盐酸,有气体放出。凭此现象,判断沉淀中含有;
(3)为了进一步探究沉淀的成分,进而确定假设中何种假设成立,设计实验,装置图如下: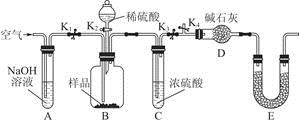
①研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为、洗涤、干燥;
②装置E中药品的名称是作用为;
③实验过程中有以下操作步骤:a.打开K1、K3,关闭K2、K4,通入过量空气。此步骤的作用是。
b.关闭K1、K3,打开K2、K4,充分反应,c.再通入过量空气时,活塞处于打开的是,关闭的是。
④若沉淀样品的质量为m g,装置D的质量增加了n g;若沉淀样品为纯净物,m、 n之间的关系为。
若假设三成立,则Cu(OH)2的质量分数为;若不进行步骤c,则会使测得结果(填“偏高”“无影响”“偏低”)。