常温下,对于0.1 mol.L-1pH= 10的Na2CO3溶液,下列说法正确的是
| A.通入CO2,溶液pH减小 |
B.加入NaOH固体,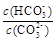 增大 增大 |
| C.由水电离的c(OH-) = 1×10-10 mol.L-1 |
| D.溶液中:c(CO32-)>c(OH-)>c(HCO3-) |
往100mL pH=0的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为
| A.0.02mol | B.0.08ml | C.0.10mol | D.0.16mol |
把铁与铜的混合物放入稀硝酸中,反应后过滤,把滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的金属盐是( )
| A.Cu(NO3)2 | B.Fe(NO3)3 |
| C.Fe(NO3)2 | D.Fe(NO3)2和Cu(NO3)2 |
向100 mL 0.1mol·L—1硫酸铝铵[NH4Al(SO4)2] 溶液中逐滴滴入0.1 mol·L—1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是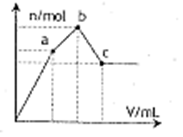
| A.a点的溶液呈酸性 |
| B.b点反应的离子方程式是:A13++2SO42—+2Ba2++3OH—=A1(OH)3↓+2BaSO4↓ |
| C.c点加入Ba (OH)2溶液的体积为200 ml. |
| D.微热,除去溶液中的氨气后,C点溶液量中性 |
某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化;(2)继续滴加NaOH溶液,白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,做出如下沉淀与滴入氢氧化钠体积的关系:
下列说法错误的是
| A.该未知溶液中至少含有3种阳离子 |
| B.滴加的NaOH溶液的物质的量浓度为5 mol/L |
| C.若另一种离子为二价阳离子,则a=10 |
| D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g |
试管中盛装的是红棕色气体(可能是两种气体的混合物),当倒扣在盛水的水槽中时,试管内水面上升,但不能充满试管,当试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,则原来试管中盛装的气体是()
| A.一定是O2与NO2的混合气体 | B.可能是NO和NO2的混合气体 |
| C.可能是N2与NO2的混合气体 | D.只可能是NO2一种气体 |