在一固定容积的密闭容器中,进行如下反应:
C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
27.反应后物质的总能量增大,则该反应为________反应(填“吸热”或“放热”)。
28.不能判断该反应是否达到化学平衡状态的是________(选填编号)。
a.容器中气体压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(H2O)=c(CO)
29.若容器容积为2L,反应10s后测得混合气体的总质量增加了2.4g, 则CO的平均反应速率为 mol/(L∙S);若再增加固态碳的量,则正反应的速率 (选填“增大”、“减小”、“不变”)。
下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。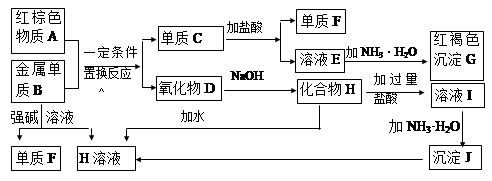
(1)G加热可分解生成A,A的化学式为________,写出物质A的一种用途。
(2)写出单质B与强碱溶液反应的离子方程式_______________________________________,写出由沉淀J生成 H溶液的离子方程式___________________________________________.。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式_______________________,白色沉淀L会迅速变为色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
(4)溶液I中所含金属离子是_____________________。
有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫红色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
(2)写出实验④中的离子反应方程式,
(3)不能确定是否存在的离子有__________________________。请设计简单实验方案证明它(们)是否存在(写出实验方法、现象、结论)__________ _________。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一粒绿
豆大小的金属钠,观察到的现象正确的是________________。
A B C D
(2)金属钠失火时,应该用灭火。
(3)过氧化钠可用作潜水艇的供养剂,主要化学反应方程式为。
(4)实验室盛放氢氧化钠溶液的试剂瓶不用玻璃塞,是因为玻璃中含(填化学式),刻蚀玻璃常用的试剂是氢氟酸,发生反应的化学方程式为。
(5)制取水泥和陶瓷的共同原料是。
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
KClO3+HCl(浓)=KCl+ClO2+Cl2+H2O
(1)配平以上化学方程式(化学计量数填入划线上)并用双线桥标出电子转移的方向和数目。
(2)反应中的氧化剂是, ClO2是反应的(填氧化或还原)产物。
(3)反应产生0.1 mol Cl2,则转移的电子的物质的量为mol。
(4)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位物质的量得到电子数表示)是Cl2的倍。
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为;
(2)x=;
(3)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=
mol;
(4)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为。