氯是重要的非金属元素。
30.NaCl和浓硫酸微热制取氯化氢的化学方程式为 ;
可用 试纸放在瓶口以检验氯化氢气体是否集满。
31.新制氯水中含有的分子有:Cl2、H2O和 ;光照新制氯水的化学方程式为 ;工业是用电解食盐水制取氯气,阴极的电极反应式为:
2H++2e→H2↑,则阳极的电极反应式为 。
32.已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是______(选填编号)。
a. NaCl Na2SO4 b. NaCl NaBr Na2SO4
c. NaCl Na2SO4 I2 d. NaCl NaI Na2SO4
具有相同和不同的同一种元素的原子互称为同位素。
根据下列几种粒子的结构示意图,回答问题:(填粒子符号)
(1)其中属于阴离子的是,
(2)属于金属元素的是,
(3)具有相似化学性质的是。
在化学符号ZAX中,A表示;Z表示。
已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应
① A + H2O → B + C② C + F → D③ D + NaOH  F + E + H2O
F + E + H2O
(1)写出它们的化学式:A、B、 D、
E、F;
(2)写出各步反应的离子方程式,并指反应①的氧化剂和还原剂物质的量比。
①、氧化剂与还原剂物质的量比为:。
②。
③。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式。
某校高一研究性学习小组将造成我省某市空气污染的主要原因分为以下四种:
| A.燃烧农作物秸秆 | B.燃烧含硫煤 | C.粉尘污染 | D.机动车尾气污染 |
并就造成该市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示: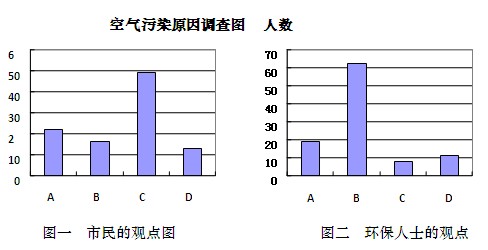
(1)调查结果显示:该市市民认为造成空气污染的最主要原因是,环保人士认为造成该市空气污染的最主要原因是。
(2)调查结果说明市民对造成空气污染的最主要原因认识不足。该最主要原因造成的大气污染的主要有害成分是,空气中该成分含量较高时,在空气中的氧气和水的共同作用下,会形成酸雾,其化学反应方程式为
(3)下列措施能够减少空气中该成分排放量的是
①用天然气代替煤炭做民用燃料②改进燃烧技术,提高热能利用率③工厂生产时将燃煤锅炉的烟囱造得更高④燃煤中加入适量石灰石后使用