由一价离子组成的四种盐AC、BD、AD、BC均为0.1 mol/L溶液,在同温下,前两种溶液pH=7,第三种溶液pH>7,最后一种溶液pH<7, 则形成四种盐的酸和碱强弱比较正确的是
| |
A |
B |
C |
D |
| 碱 性 |
AOH>BOH |
AOH>BOH |
AOH<BOH |
AOH<BOH |
| 酸 性 |
HC<HD |
HC>HD |
HC>HD |
HC< HD |
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
| A.同温下pH=1和pH=2的盐酸,c(H+)之比为1:2 |
| B.物质A三态间的转化如下:A(g)→A(1)→A(s),则该转化过程中△S<O |
| C.pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均减小 |
| D.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液,两溶液中水的电离程度相同 |
下列是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 |
AgCl |
Ag2CrO4 |
CH3COOH |
HClO |
H2CO3 |
| Ksp或Ka |
Ksp=1.8×10-10 |
Ksp=9.0×10-12 |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO
C.向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5
D.向浓度均为1.0×10-3 mol·L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol·L-1的AgNO3溶液,CrO42―先形成沉淀
常温下用惰性电极电解1 L含足量KCl的溶液,若通过n mol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变,生成的气体全部逸出)
| A.pH=n | B.pH=-lg n | C.pH=14-lgn | D.pH=lgn+14 |
某学习小组的同学在学习了化学反应速率与化学平衡知识后,对反应:aA(g)+bB(g) cC(g)+dD(g)
cC(g)+dD(g) 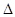 H,反应特点与对应的图象展开了讨论,其中不正确的是
H,反应特点与对应的图象展开了讨论,其中不正确的是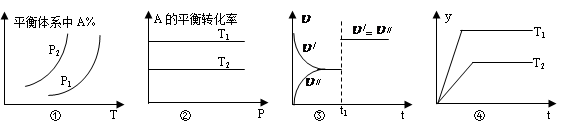
| A.图①中,若P1>P2,则该反应在较低温度下有利于自发进行 |
B.图②中,若T2>T1,则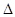 H<0且a+b=c+d H<0且a+b=c+d |
C.图③中(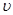 /表示正反应速率, /表示正反应速率,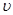 //表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 //表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 |
D.图④中,若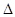 H<0,则纵坐标不可能表示的是反应物的转化率 H<0,则纵坐标不可能表示的是反应物的转化率 |
下列有关叙述中不正确的是
| A.相同温度下,0.02 mol·L-1的醋酸溶液与0.01 mol·L-1的醋酸溶液中的c(H+)之比小于2 :1 |
| B.相同温度下,0.1 mol·L-1 (NH4)2SO4溶液与0.1 mol·L-1 NH4NO3溶液中c(NH4+)之比大于2 :1 |
| C.在0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液,当溶液pH=7时,加入CH3COOH溶液的体积与NaOH溶液的体积比小于2:1 |
| D.40 ℃时,pH=7的(NH4)2SO4与NH3•H2O的混合溶液中c(NH4+)与c(SO42-)之比小于2 :1 |