高温下,某反应达平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.恒温恒容下,增大压强,H2浓度一定减小 | B.该反应的焓变为正值 |
| C.该反应化学方程式为CO+H2O=CO2+H2 | D.升高温度,逆反应速率减小 |
根据碘与氢气反应的热化学方程式I2(g)+ H2(g)  2HI(g) △H=- 9.48 kJ·mol-1
2HI(g) △H=- 9.48 kJ·mol-1
(ii) I2(s)+ H2(g) 2HI(g) △H= +26.48kJ·mol-1下列判断正确的是
2HI(g) △H= +26.48kJ·mol-1下列判断正确的是
| A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(i)的产物比反应(ii)的产物稳定 |
| D.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
如下图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)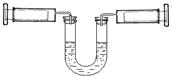
| A.压缩后U型管内两侧液面仍然保持水平 |
B.对于2NO2 N2O4平衡体系,向生成N2O4的方向移动 N2O4平衡体系,向生成N2O4的方向移动 |
| C.左侧气体颜色先变深后逐渐变浅(比原来深) |
| D.若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平 |
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),△H="-1025" kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g),△H="-1025" kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是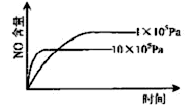
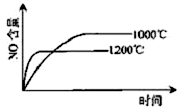
A. B.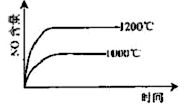
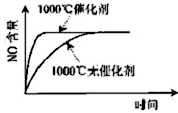
C.D.
在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g) 3C(g)+2D(g),达到平衡状态的是
3C(g)+2D(g),达到平衡状态的是
A.混合气的平均相对分子质量不再改变
B.反应器内A、B、C、D物质的量比为1:3:3:2
C.容器内密度不随时间变化而变化
D.生成 1mol A同时有3 mol C被消耗